题目内容
氮化铝广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应Al2O3+N2+3C=2AlN+3CO合成.下列叙述正确的是( )
| A、上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B、上述反应中,每生成1 molAlN需转移3 mol电子 |
| C、AlN中氮元素的化合价为+3 |
| D、AlN的摩尔质量为41g |
考点:氧化还原反应
专题:
分析:A.在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
B.根据氮化铝和转移电子之间的关系式计算;
C.在化合物中电负性大的显负价,电负性小的显正价;
D.摩尔质量的单位是g/mol.
B.根据氮化铝和转移电子之间的关系式计算;
C.在化合物中电负性大的显负价,电负性小的显正价;
D.摩尔质量的单位是g/mol.
解答:
解:A.该反应中,氧化剂是氮气,还原剂是碳,故A错误;
B.每生成1molAlN需转移1mol×(3-0)=3mol电子,故B正确;
C.氮化铝中氮元素的化合价是-3价,故C错误;
D.氮化铝的摩尔质量是41g/mol,故D错误;
故选B.
B.每生成1molAlN需转移1mol×(3-0)=3mol电子,故B正确;
C.氮化铝中氮元素的化合价是-3价,故C错误;
D.氮化铝的摩尔质量是41g/mol,故D错误;
故选B.
点评:本题考查氧化还原反应,明确元素化合价即可分析解答本题,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
一定温度下,向AgCl饱和溶液中,加入少量NaCl固体,达到平衡时( )
| A、c(Ag+)≠c(Cl-),c(Ag+)?c(Cl-)≠Ksp(AgCl) |
| B、c(Ag+)≠c(Cl-),c(Ag+)?c(Cl-)=Ksp(AgCl) |
| C、c(Ag+)=c(Cl-),c(Ag+)?c(Cl-)≠Ksp(AgCl) |
| D、c(Ag+)=c(Cl-),c(Ag+)?c(Cl-)=Ksp(AgCl) |
下列说法正确的是( )
| A、镀层破损后白铁(镀锌铁)比马口铁(镀锡铁)中的铁更易腐蚀 |
| B、SO2(g)+2H2S(g)═3S(s)+2H2O(l) 在常温下能自发进行,则该反应的△H>0 |
| C、0.1 mol?L-1CH3COOH溶液中加入少量水,CH3COOH电离程度和溶液pH均增大 |
| D、在N2+3H2?2NH3平衡体系中加入少量催化剂,反应速率和平衡常数均增大 |
把SO2通入Fe(NO3)3溶液中,溶液由黄色变为浅绿色,但立即又变为黄色,此时若滴入BaCl2溶液,则会产生白色沉淀.在上述一系列变化过程中,最终被还原的是( )
| A、SO2 |
| B、NO3- |
| C、Fe3+ |
| D、Fe2+ |
下列反应中,不属于氧化还原反应的是( )
A、2 H2O2
| ||||
B、2 Al(OH)3
| ||||
C、Fe2O3+3 CO
| ||||
| D、Cl2+2 NaOH═NaCl+NaClO+H2O |
在一定条件下,可发生反应:XO3n-+Cl2+2OH-═XO42-+2Cl-+H2O.则XO3n-中X元素的化合价是( )
| A、+4 | B、+5 | C、+6 | D、+7 |
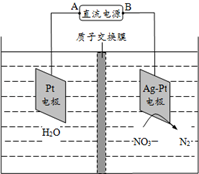 化学市场应用于环境保护.硝酸盐在消化道中可被还原成亚硝酸盐,亚硝酸盐可将低铁红蛋白氧化成高铁红蛋白,使之失去输氧能力,亚硝酸盐还可与仲胺类化合物反应生成亚硝胺类的致癌物质.长期饮用含高浓度硝酸盐的水,会使人畜中毒.目前关于硝酸盐危害的报道主要是“蓝婴儿综合征”.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示:
化学市场应用于环境保护.硝酸盐在消化道中可被还原成亚硝酸盐,亚硝酸盐可将低铁红蛋白氧化成高铁红蛋白,使之失去输氧能力,亚硝酸盐还可与仲胺类化合物反应生成亚硝胺类的致癌物质.长期饮用含高浓度硝酸盐的水,会使人畜中毒.目前关于硝酸盐危害的报道主要是“蓝婴儿综合征”.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示: