题目内容
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
(1)基态硅原子的电子排布式
(2)有一类组成最简单的有机硅化合物叫硅烷.硅烷的组成、结构与相应的烷烃相似.硅烷中硅采取 杂化方式,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是 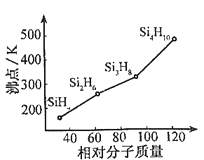
(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为 .(用元素符号表示)
(4)气态SeO3分子的立体构型为 ,与SeO3互为等电子体的一种离子为 (填化学式).
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为 ;若该晶体的晶胞棱长为a pm,则该合金密度为 g/cm3 . (列出计算式,不要求计算结果,阿伏伽德罗常数的值为NA)
【答案】
(1)1s22s22p63s23p2
(2)sp3;硅烷的相对分子质量越大,分子间范德华力越强
(3)As<Se<Br
(4)平面三角形;CO32﹣或NO3﹣
(5)1:3; ?
?
【解析】(1)硅是14号元素,根据原子核外电子排布规律可以写出电子排布式为:1s22s22p63s23p2;
故答案为:1s22s22p63s23p2;
(2)根据硅烷的分子式得出,硅烷的通式为:SinH2n+2 , 又硅烷的组成、结构与相应的烷烃相似,所以硅烷中硅采取sp3杂化方式;硅烷(SinH2n+2)都是分子晶体,分子晶体的沸点高低取决于分子间作用力,而分子间作用力与相对分子质量的大小有关,硅烷的相对分子质量越大,分子间范德华力越强;
故答案为:sp3;硅烷的相对分子质量越大,分子间范德华力越强;
(3)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右电负性增大,故电负性:As<Se<Br,
故答案为:As<Se<Br;
(4)气态SeO3分子中中心原子的价层电子对数为![]() =3,无孤电子对,所以分子构型为平面三角形,又等电子体要求原子总数相同,价电子数相同,所以与SeO3互为等电子体的一种离子为CO32﹣或NO3﹣;
=3,无孤电子对,所以分子构型为平面三角形,又等电子体要求原子总数相同,价电子数相同,所以与SeO3互为等电子体的一种离子为CO32﹣或NO3﹣;
故答案为:平面三角形;CO32﹣或NO3﹣;
(5)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×![]() =1,Cu原子个数=6×
=1,Cu原子个数=6×![]() =3,所以该合金中Au原子与Cu原子个数之比=1:3,晶胞体积V=(a×10﹣10cm)3 , 每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=
=3,所以该合金中Au原子与Cu原子个数之比=1:3,晶胞体积V=(a×10﹣10cm)3 , 每个晶胞中铜原子个数是3、Au原子个数是1,则ρ= gcm﹣3;
gcm﹣3;
故答案为:1:3; gcm﹣3;
gcm﹣3;
(1)硅是14号元素,根据原子核外电子排布规律可以写出电子排布式;
(2)根据硅烷的分子式得出,硅烷的通式为:SinH2n+2 , 又硅烷的组成、结构与相应的烷烃相似,所以硅烷中硅采取sp3杂化方式;根据SinH2n+2都是分子晶体,分子晶体的沸点高低取决于分子间作用力,而分子间作用力与相对分子质量的大小有关,据此答题;
(3)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右电负性增大;
(4)气态SeO3分子中中心原子的价层电子对数可以判断分子构型;根据等电子体要求原子总数相同,价电子数相同来确定;
(5)利用均摊法计算两种金属原子个数之比,根据ρ=![]() 计算.
计算.

 阅读快车系列答案
阅读快车系列答案【题目】化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟气脱硫。已知:
①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
CO将SO2 还原为单质硫的热化学方程式为_____________________________________。
(2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
物质 | CO | H2 | CH3OH |
浓度(mol·L-1) | 0.9 | 1.0 | 0.6 |
①反应达到平衡时,CO的转化率为_______________。
②该反应的平衡常数K=________________。
③恒温恒容条件下,可以说明反应已达到平衡状态的是__________(填标号)。
A.v正(CO)=2v逆(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
④若将容器体积压缩到1L,则达到新平衡时c(H2)的取值范围是_____________。
⑤若保持容器体积不变,再充入0.6molCO和0.4molCH3OH,此时v正__________v逆(填“>”<”或“=”)。
(3)常温下,HNO2的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kb=__________(保留两位有效数字)。



