题目内容
17.以下说法正确的是( )| A. | 电子在原子核外排布时,总是尽先排在能量最高的电子层里 | |
| B. | 原子核外各电子层最多能容纳的电子数2n2,所以钾原子的M层有9个电子 | |
| C. | 稀有气体元素都形成了稳定的电子层结构,所以这些元素一定不存在化合态 | |
| D. | 在1~18号元素中,最外层电子数等于电子层数的元素有3种 |
分析 多电子原子中,原子核外电子根据能量不同,在不同区域内运动,即分层排布,能量低的电子在离核近的区域运动,能量高的电子在离核远的区域运动,据此分析.
解答 解:A、多个电子的原子里,电子是分层排布的,电子总是尽先排在能量低的电子层里,然后才排在能量高的电子层,故A错误;
B、原子核外各电子层最多能容纳的电子数2n2,最外层不超过8个电子,故B错误;
C、稀有气体元素都形成了稳定的电子层结构,但与性质非常活泼的物质化合时会出现化合态,如XeF6,故C错误;
D、在1~18号元素中,最外层电子数等于电子层数的元素有氢、铍、铝3种,故D正确.
故选:D.
点评 本题考查了原子结构,核外电子排布规律及应用,熟悉电子离核的位置与能量的关系是解答的关键,较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.磷和氮同为VA族元素,它们对应的化合物在结构上和性质上有许多相似之处.下列对PH4I的说法中,不正确的是( )
| A. | 它是离子化合物 | B. | 它的热稳定性好 | ||
| C. | 它能与强碱发生反应 | D. | 其溶液可与AgNO3溶液发生反应 |
5.下列表示方法正确的是( )
| A. | HCl的电子式为 | B. | N2的结构式 N≡N | ||
| C. | O原子处于基态的轨道表示式: | D. | 用电子式表示MgCl2的形成: |
12.有X、Y、Z、T、U五种短周期元素.X、Y、Z三元素在周期表中的位置如图所示,三元素的原子序数之和是41.X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物.U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红.
(1)各元素的符号是:ZCl,TNa
(2)Y原子的结构示意图为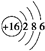 ,U2X的电子式
,U2X的电子式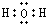
(3)YX2和U2Y反应的化学方程式为2H2S+SO2═3S↓+2H2O,其中氧化剂是SO2,被氧化的元素是S.
| X | |
| Y | Z |
(2)Y原子的结构示意图为
 ,U2X的电子式
,U2X的电子式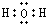
(3)YX2和U2Y反应的化学方程式为2H2S+SO2═3S↓+2H2O,其中氧化剂是SO2,被氧化的元素是S.
9.CH3-CH2-OH和CH3-O-CH3互为( )
| A. | 同分异构体 | B. | 同素异形体 | C. | 同位素 | D. | 同系物 |
 .
.
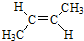 .
.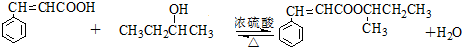 .
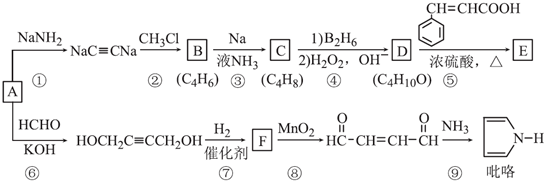
.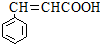 )的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有7种(不考虑顺反异构).与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是CH3CH2OCH2CH3.
)的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有7种(不考虑顺反异构).与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是CH3CH2OCH2CH3.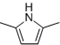 )的合成路线
)的合成路线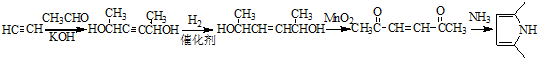 .
.