题目内容
8.以含Fe2O3、FeO、SiO2、Al2O3的混合物为原料,设计两种制备铁红(Fe2O3)的方案,部分产物已略去.[方案1]

[方案2]

(1)溶液A所含的阳离子有Fe3+、Fe2+、Al3+、(H+).
(2)加入双氧水的作用是将Fe2+全部转化为Fe3+.
(3)固体C的成分是Fe(OH)3(填化学式).
(4)试剂x可以选择a(填序号).
a.NaOH溶液 b.氨水 c.二氧化碳 d.稀H2SO4
(5)用试剂x浸取原料发生的离子方程式是SiO2+2OH-=SiO32-+H2O、Al2O3+2OH-=2AlO2-+H2O.
分析 [方案1]原料(主要含Fe2O3、FeO,Al2O3和SiO2等)加硫酸溶解,滤液中含有阳离子Fe3+、Fe2+、Al3+、(H+),经H2O2氧化处理,溶液中含有阳离子Fe3+、Al3+,向其中加入足量的氢氧化钠,反应生成Fe(OH)3和NaAlO2;沉淀Fe(OH)3经煅烧得到铁红.
[方案2]原料(主要含Fe2O3、FeO,Al2O3和SiO2等)加NaOH发生SiO2+2OH-=SiO32-+H2O、Al2O3+2OH-=2AlO2-+H2O,过滤后固体D为Fe2O3、FeO,加入硫酸并加入H2O2可使Fe2+转化为Fe3+,加入氢氧化钠,反应生成Fe(OH)3,沉淀Fe(OH)3经煅烧得到铁红.
解答 解:(1)含Fe2O3、FeO、SiO2、Al2O3的混合物为原料加硫酸溶解,溶液A所含的阳离子有Fe3+、Fe2+、Al3+、(H+),
故答案为:Fe3+、Fe2+、Al3+、(H+);
(2)溶液A经H2O2氧化处理,将Fe2+ 全部转化为Fe3+,
故答案为:将Fe2+ 全部转化为Fe3+;
(3)向含有阳离子Fe3+、Al3+的溶液中加入足量的氢氧化钠,反应生成Fe(OH)3和NaAlO2,固体C的成分是Fe(OH)3,
故答案为:Fe(OH)3;
(4)试剂x可以选择氢氧化钠,
故答案为:a;
(5)用试剂x(氢氧化钠)浸取原料发生的离子方程式是:SiO2+2OH-=SiO32-+H2O、Al2O3+2OH-=2AlO2-+H2O,
故答案为:SiO2+2OH-=SiO32-+H2O、Al2O3+2OH-=2AlO2-+H2O.
点评 本题以框图题形式考查铝、铁的化合物的性质,难度中等,难度不大,清楚工艺流程原理是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.对于下列两个转化关系,说法不正确的是( )
(1)FeS2$\stackrel{①}{→}$SO2$\stackrel{②}{→}$SO3$\stackrel{③}{→}$H2SO4
(2)N2$\stackrel{④}{→}$NO$\stackrel{⑤}{→}$NO2$\stackrel{⑥}{→}$HNO3$\stackrel{⑦}{→}$KNO3.
(1)FeS2$\stackrel{①}{→}$SO2$\stackrel{②}{→}$SO3$\stackrel{③}{→}$H2SO4
(2)N2$\stackrel{④}{→}$NO$\stackrel{⑤}{→}$NO2$\stackrel{⑥}{→}$HNO3$\stackrel{⑦}{→}$KNO3.
| A. | (1)符合工业接触法制硫酸的流程 | |
| B. | (2)反映出“雷雨发庄稼”的实质 | |
| C. | 反应②的条件为“催化剂、加热”,属于不可逆反应 | |
| D. | 反应④属于“氮的固定” |
16.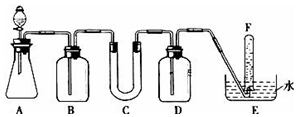 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品.用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品.用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
(1)填写表中空格:
已知A中放有碳酸钙,分液漏斗装稀盐酸
(2)为了达到实验目的,不需要(填“需要”或“不需要”)在B装置之后增加一个吸收水蒸气的装置;
(3)试管F中收集满气体后,下一步实验操作是:把E中的导管移出水面,关闭分液漏斗的活塞,用拇指堵住试管口,取出试管,立即用带火星的木条伸到试管F的管口,如果木条复燃,说明过氧化钠与二氧化碳反应产生氧气,可做供氧剂.
 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品.用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品.用图中的实验装置进行实验,证明过氧化钠可作供氧剂.(1)填写表中空格:
已知A中放有碳酸钙,分液漏斗装稀盐酸
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2气体中混入的HCl |
| C | 石棉绒与过氧化钠 | 与CO2反应,产生O2 |
| D | NaOH溶液 | 吸收未反应的CO2气体 |
(3)试管F中收集满气体后,下一步实验操作是:把E中的导管移出水面,关闭分液漏斗的活塞,用拇指堵住试管口,取出试管,立即用带火星的木条伸到试管F的管口,如果木条复燃,说明过氧化钠与二氧化碳反应产生氧气,可做供氧剂.
3. 科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种,其结构如图.下列关于化合物A的说法正确的是( )
科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种,其结构如图.下列关于化合物A的说法正确的是( )
 科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种,其结构如图.下列关于化合物A的说法正确的是( )
科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种,其结构如图.下列关于化合物A的说法正确的是( )| A. | 化合物A的分子式为C15H22O3 | |
| B. | 与FeCl3溶液发生反应后溶液显紫色 | |
| C. | 1molA最多能与2mol新制的Cu(OH)2悬浊液反应 | |
| D. | 1molA最多能与1molH2发生加成反应 |
1.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 已知C-C键可以绕键轴自由旋转,结构简式为 分子中有6个碳原子处于同一直线上 分子中有6个碳原子处于同一直线上 |
8.在下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计的水银球靠近蒸馏烧瓶的瓶底 | |
| C. | 过滤时,玻璃棒在引流过程中应放在三层滤纸处 | |
| D. | 称量时,称量物置于托盘天平左盘,砝码放在托盘天平右盘 |
5.海带中含碘元素.从海带中提取碘有如下步骤:①通入适量Cl2;②将海带灼烧成灰后加蒸馏水搅拌;③加CCl4振荡;④过滤.合理的操作顺序是( )
| A. | ①②③④ | B. | ②①③④ | C. | ①③②④ | D. | ②④①③ |
6.为了除去粗盐中的Ca2+、Mg2+、SO42-,可将粗盐溶于水,然后进行 ①过滤②加适量的NaOH溶液③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液等五项操作.正确的操作顺序是( )
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ③⑤②④① |
