题目内容
8.乙炔的电子式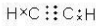 .
.
分析 乙炔的结构式为H-C≡C-H,C、H之间形成1对共用电子对,C、C之间形成3对共用电子对,以此来解答.
解答 解:乙炔的结构式为H-C≡C-H,C、H之间形成1对共用电子对,C、C之间形成3对共用电子对,其电子式为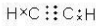 ,
,
故答案为: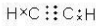 .
.
点评 本题考查化学用语,为高频考点,把握乙炔的结构、电子式的书写为解答的关键,侧重分析与应用算能力的考查,注意乙炔中C与C之间的电子对,题目难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目
16.下列说法正确的是( )
①Na2O、Fe2O3属于碱性氧化物,CO2、SO2、NO2都能和碱溶液发生反应属于酸性氧化物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤盐酸属于混合物,而液氯、冰醋酸均属于纯净物.
①Na2O、Fe2O3属于碱性氧化物,CO2、SO2、NO2都能和碱溶液发生反应属于酸性氧化物
②碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物
③蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤盐酸属于混合物,而液氯、冰醋酸均属于纯净物.
| A. | ①③⑤ | B. | ①④⑤ | C. | ②③④ | D. | ②④⑤ |
16.在容积体积为2L的恒定密闭容器中,一定量的SO2与浓度为1.1mol•L-1的 O2发生反应:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H<0.6min时,当气体的物质的量减少0.63mol时,反应达到平衡,SO2的平衡转化率是90%.下列说法正确的是( )
| A. | 相同条件下,平衡时若充入稀有气体,SO2的转化率增大 | |
| B. | 0~6 min的平衡反应速率:v(O2)=0.105 mol/(L•min) | |
| C. | 保持其他条件不变,仅降低温度,正反应速率减小程度比逆反应速率减小程度大 | |
| D. | 反应开始时,向容器中通入的SO2的物质的量是1.4 mol |
3.控制变量法是化学实验中的一种常用方法,如表是某课外兴趣小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点后一位),分析以下数据,回答下列问题:
(1)实验①和实验②表明温度对反应速率有影响,对这一规律进行研究的实验还有一组是③和④(填实验序号).研究锌的形状对反应速率的影响时,我们最好选取实验②、③和⑤(填3个实验序号).上述实验发生反应的化学方程式为Zn+H2SO4(稀)=ZnSO4+H2↑.
(2)下列数据推断正确的是AD
A.t1<70 B.t1>t4 C.m1<m2 D.m6=19.3
(3)若采用与实验①完全相同的条件,但向反应窗口中滴加少量硫酸铜溶液,发现反应速率明显加快,原因是CuSO4与Zn反应产生的Cu,Cu与Zn形成铜锌原电池,加快了H2产生的速率.
(4)硫酸的物质的量浓度是2.4mol/L,实验⑥生成的硫酸锌的质量m5=9.9g.
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| ① | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
| ② | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
| ③ | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
| ④ | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
| ⑤ | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| ⑥ | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
| ⑦ | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
| ⑧ | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
| ⑨ | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
| ⑩ | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
(2)下列数据推断正确的是AD
A.t1<70 B.t1>t4 C.m1<m2 D.m6=19.3
(3)若采用与实验①完全相同的条件,但向反应窗口中滴加少量硫酸铜溶液,发现反应速率明显加快,原因是CuSO4与Zn反应产生的Cu,Cu与Zn形成铜锌原电池,加快了H2产生的速率.
(4)硫酸的物质的量浓度是2.4mol/L,实验⑥生成的硫酸锌的质量m5=9.9g.
13.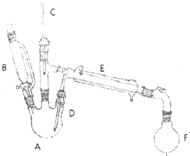 溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:
溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:
主反应:
NaBr+H2SO4$\stackrel{△}{→}$HBr+NaHSO4
C2H5OH+HBr$\stackrel{△}{→}$C2H5Br+H2O
副反应:在该实验中经常会有乙醚、溴等副产物生成.
实验步骤:
①向A中先加入5mL 95%的无水乙醇(0.085mol)和4.5mL的水,加入溴化钠7.725g,再加入沸石,摇匀.在接受器F中加冷水及3ml饱和亚硫酸氢钠溶液,并将其放入冰水浴中.
②在B中加入9.5mL浓硫酸(0.17mol),向A中缓缓滴入浓硫酸,加热体系,控制反应温度,保持反应平稳地发生,直至无油状物馏出为止;
③分出馏出液中的有机层,加入1-2mL浓硫酸以除去乙醚、乙醇、水等杂质,溶液明显分层后,分离得到粗产物;
④将粗产物转入蒸馏瓶中,加沸石,在水浴上加热蒸馏,收集35-40℃的馏分,称量得5.23g.
回答问题:
(1)仪器A的名称为三颈烧瓶
(2)步骤①在接受器F中加冷水以及将F放入冰水浴中的目的是溴乙烷沸点低、极易挥发,冰水主要可以防止溴乙烷的挥发饱和亚硫酸氢钠溶液的作用是除去反应中的副产物溴
(3)步骤②中浓硫酸要缓缓滴加而不一次加入,其作用有abd(填标号).
a.可以防止乙醇发生碳化 b.避免生成HBr的速度过快,减少其挥发
c.避免溶液发生暴沸 d.减少因浓硫酸氧化HBr而生成副产物溴
(4)步骤③中分出馏出液中有机层的操作名称为分液;:加入浓硫酸除杂后的溶液明显分层,粗产物在上层(填“上”或“下”).
(5)本实验的产率为64%.
 溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:
溴乙烷是有机合成的重要原料,实验室合成溴乙烷的装置示意图、相关原理和数据如下:主反应:
NaBr+H2SO4$\stackrel{△}{→}$HBr+NaHSO4
C2H5OH+HBr$\stackrel{△}{→}$C2H5Br+H2O
副反应:在该实验中经常会有乙醚、溴等副产物生成.
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解度 | |
| 乙醇 | 46 | 0.789 | 78.3 | 易溶 |
| 溴乙烷 | 109 | 1.46 | 38.2 | 难溶 |
| 浓硫酸(H2SO4) | 98 | 1.84 | 338.0 | 易溶 |
①向A中先加入5mL 95%的无水乙醇(0.085mol)和4.5mL的水,加入溴化钠7.725g,再加入沸石,摇匀.在接受器F中加冷水及3ml饱和亚硫酸氢钠溶液,并将其放入冰水浴中.
②在B中加入9.5mL浓硫酸(0.17mol),向A中缓缓滴入浓硫酸,加热体系,控制反应温度,保持反应平稳地发生,直至无油状物馏出为止;
③分出馏出液中的有机层,加入1-2mL浓硫酸以除去乙醚、乙醇、水等杂质,溶液明显分层后,分离得到粗产物;
④将粗产物转入蒸馏瓶中,加沸石,在水浴上加热蒸馏,收集35-40℃的馏分,称量得5.23g.
回答问题:
(1)仪器A的名称为三颈烧瓶
(2)步骤①在接受器F中加冷水以及将F放入冰水浴中的目的是溴乙烷沸点低、极易挥发,冰水主要可以防止溴乙烷的挥发饱和亚硫酸氢钠溶液的作用是除去反应中的副产物溴
(3)步骤②中浓硫酸要缓缓滴加而不一次加入,其作用有abd(填标号).
a.可以防止乙醇发生碳化 b.避免生成HBr的速度过快,减少其挥发
c.避免溶液发生暴沸 d.减少因浓硫酸氧化HBr而生成副产物溴
(4)步骤③中分出馏出液中有机层的操作名称为分液;:加入浓硫酸除杂后的溶液明显分层,粗产物在上层(填“上”或“下”).
(5)本实验的产率为64%.
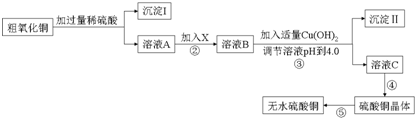
20.某化学活动小组按如图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜.
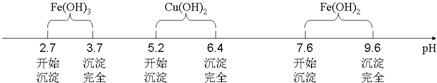
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:
请回答下列问题:
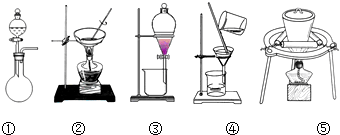
(1)在整个实验过程中,下列实验装置不可能用到的是①③(填序号)
(2)物质X应选用②(填序号)
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(3)从溶液C中制取硫酸铜晶体的实验操作为蒸发浓缩 冷却结晶、过滤、自然干燥.
(4)用“间接碘量法”可以测定溶液A中Cu2+(不含能与I-发生反应的杂质)的浓度.过程如下:
第一步:移取10.00mL溶液A于100mL容量瓶,加水定容至100mL.
第二步:取稀释后试液20.00mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质.
(已知2Cu2++4I-=2CuI↓+I2)
第三步:以淀粉溶液为指示剂,用0.05000mol•L-1的Na2S2O3标准溶液滴定,前后共测定三组.达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:(已知:I2+2S2O32-═2I-+S4O62-)
①滴定中,试液Na2S2O3应放在碱式滴定管(填“酸式滴定管”或“碱式滴定管”),滴定终点的现象是
最后一滴试液滴入,溶液由蓝色变为无色,振荡半分钟,溶液无明显变化.
②溶液A中c(Cu2+)=0.5000mol/L.

已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:

请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是①③(填序号)

(2)物质X应选用②(填序号)
①氯水 ②双氧水 ③铁粉 ④高锰酸钾
(3)从溶液C中制取硫酸铜晶体的实验操作为蒸发浓缩 冷却结晶、过滤、自然干燥.
(4)用“间接碘量法”可以测定溶液A中Cu2+(不含能与I-发生反应的杂质)的浓度.过程如下:
第一步:移取10.00mL溶液A于100mL容量瓶,加水定容至100mL.
第二步:取稀释后试液20.00mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质.
(已知2Cu2++4I-=2CuI↓+I2)
第三步:以淀粉溶液为指示剂,用0.05000mol•L-1的Na2S2O3标准溶液滴定,前后共测定三组.达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:(已知:I2+2S2O32-═2I-+S4O62-)
| 滴定次数 | 第一次 | 第二次 | 第三次 |
| 滴定前读数(mL) | 0.10 | 0.36 | 1.10 |
| 滴定滴定后读数(mL) | 20.12 | 20.34 | 22.12 |
最后一滴试液滴入,溶液由蓝色变为无色,振荡半分钟,溶液无明显变化.
②溶液A中c(Cu2+)=0.5000mol/L.
17. 有机物的反应往往伴随副反应发生,因此 需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此 需要分离提纯.有一种水果香精的合成步骤如下:
Ⅰ合成:
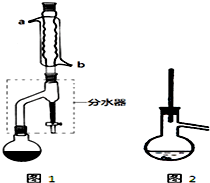
在干燥的圆底烧瓶中加入11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离提纯:
①将烧瓶中反应后的混合物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水、10mL 10% 碳酸钠溶液洗至中性,充分振荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥.
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.
主要试剂及产物的物理常数如下:
制备过程中还可能有的副反应:
2CH3CH2CH2CH2OH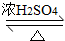 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
(1)合成和分离过程中均使用沸石,其作用防止液体加热时发生暴沸.
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从b(填a或b)管口通入.
(3)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先过滤(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有正丁醚杂质.
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在BD中加热比较合适(请从下列选项中选择).
A.水 B.甘油(沸点290℃)
C.沙子 D.石蜡油(沸点200~300℃)
(5)如何根据装置中的实验现象判断该合成反应达到了终点分水器中水面不再升高.
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的利用率约为88%.
 有机物的反应往往伴随副反应发生,因此 需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此 需要分离提纯.有一种水果香精的合成步骤如下:Ⅰ合成:
在干燥的圆底烧瓶中加入11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离提纯:
①将烧瓶中反应后的混合物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水、10mL 10% 碳酸钠溶液洗至中性,充分振荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥.
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.
主要试剂及产物的物理常数如下:
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
2CH3CH2CH2CH2OH
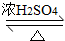 CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O(1)合成和分离过程中均使用沸石,其作用防止液体加热时发生暴沸.
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从b(填a或b)管口通入.
(3)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先过滤(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有正丁醚杂质.
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在BD中加热比较合适(请从下列选项中选择).
A.水 B.甘油(沸点290℃)
C.沙子 D.石蜡油(沸点200~300℃)
(5)如何根据装置中的实验现象判断该合成反应达到了终点分水器中水面不再升高.
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的利用率约为88%.
18.下列关于Li、Na、K、Rb性质的比较,不正确的是( )
| A. | 它们的原子核外电子层数随质子数的增加而增多 | |
| B. | 它们的L层电子数都相同 | |
| C. | 它们的原子核对最外层电子的引力逐渐减弱 | |
| D. | 它们与氧气或水反应时越来越剧烈 |