题目内容
15.下列有关几种常见的金属和非金属及其化合物的说法正确的是( )| A. | Na、Mg、Al、Fe、Cu都能导电,它们的氧化物都能与酸反应 | |
| B. | 铝热反应是指铝能将所有的金属从其氧化物中置换出来 | |
| C. | CO2、NO、SO2都是非金属氧化物,都属于酸性氧化物 | |
| D. | CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑的发生,说明硅酸的酸性强于碳酸 |
分析 A.金属中均存在自由电子,金属氧化物与酸反应生成盐和水;
B.铝热反应用于制备比Al不活泼且熔点高的某些金属;
C.NO与碱不反应;
D.CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑不在溶液中进行,不体现酸性.
解答 解:A.金属都能导电,且Na、Mg、Al、Fe、Cu氧化物都能与酸反应生成相应盐和水,故A正确;
B.铝热反应本质是置换反应,能把不如Al的活泼的金属从其氧化物中置换出来,不能置换比Al活泼的金属,故B错误;
C. CO2、SO2是酸性氧化物,但NO不是酸性氧化物,NO为不成盐氧化物,故C错误;
D.反应在高温条件下进行,不是在溶液中进行的反应,不能说明酸的酸性强于碳酸,故D错误.
故选A.
点评 本题考查金属及化合物的性质,综合考查元素及化合物知识,为高频考点,把握相关概念、物质的性质及反应原理的分析与应用为解答的关键,基础性较强,题目难度不大.

练习册系列答案
相关题目
5.PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将l mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3:2.则剩余固体的组成及物质的量比是( )
| A. | 1:1混合的Pb3O4、PbO | B. | 1:2混合的PbO2、Pb3O4 | ||
| C. | 1:4:l混合的PbO2、Pb3O4、PbO | D. | 1:1:l 混合的PbO2、Pb3O4、PbO |
3.能产生“丁达尔效应”的是( )
| A. | 泥水 | B. | 淀粉溶液 | C. | 氯化铁溶液 | D. | 稀硫酸 |
10.关于如图所示装置的叙述,正确的是( )
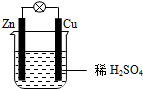

| A. | Cu为负极,Zn为正极 | B. | 电子从铜片经外电路流向锌片 | ||
| C. | 负极反应为:Zn-2e-═Zn2+ | D. | 该装置将电能转化为化学能 |
20.光具有能量,能影响很多反应.下列反应中,受光照影响不够显著的是( )
| A. | 植物体中的叶绿素把CO2 和水转化为葡萄糖 | |
| B. | 次氯酸的分解 | |
| C. | 铁与氧气的反应 | |
| D. | 甲烷与氯气的反应 |
7.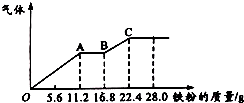 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 混合酸中H2SO4浓度为4 mol•L-1 | |
| B. | 200mL混合酸中NO3-物质的量为0.2mol | |
| C. | AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | |
| D. | 加入铜粉的那份混合酸,反应后剩余0.1mol H2SO4 |
5.常温下,下列各组离子一定能大量共存的是( )
| A. | c(H+)=10-4 mol•L-1的溶液中:NH4+、K+,SO42-,NO3- | |
| B. | 无色溶液中:Na+,Cu2+,Cl-,NO3- | |
| C. | 0.1mol•L-1 AgNO3溶液中:H+,K+,SO42-,I- | |
| D. | 饱和氯水中:Cl-,Na+,NO3-,SO32- |

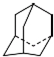 ,用一个氯原子与一个溴原子取代后形成的二元取代物数目为( )
,用一个氯原子与一个溴原子取代后形成的二元取代物数目为( )