题目内容
18.某烃含有一个碳碳三键,与氢气发生加成反应后,产物结构简式为 ,则该烃的可能的结构有几种( )
,则该烃的可能的结构有几种( )| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
分析 加成反应指有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应.
根据加成原理采取逆推法还原C≡C,烷烃分子中相邻碳原子上至少均带2个氢原子的碳原子间是对应炔烃存在C≡C三键的位置.
还原三键时注意:先判断该烃结构是否对称,如果对称,只考虑该分子一边的结构和对称线两边相邻碳原子即可;如果不对称,要全部考虑,然后各去掉相邻碳原子上的2个氢原子形成三键.
解答 解:根据炔烃与H2加成反应的原理,推知该烷烃分子中相邻碳原子上均带2个氢原子的碳原子间是对应炔存在C≡C的位置.该烷烃的碳链结构为 ,3号碳原子上无H原子,5号碳原子上有1个H原子,故3号和5号碳原子均不能与相邻的碳原子形成C≡C,能形成三键位置有:1和2之间;6和7之间,8和9之间,6和7与8和9形成的碳碳三键位置相同,故该炔烃共有2种.
,3号碳原子上无H原子,5号碳原子上有1个H原子,故3号和5号碳原子均不能与相邻的碳原子形成C≡C,能形成三键位置有:1和2之间;6和7之间,8和9之间,6和7与8和9形成的碳碳三键位置相同,故该炔烃共有2种.
故选C.
点评 本题以加成反应为载体,考查同分异构体的书写,理解加成反应原理是解题的关键,采取逆推法还原C≡C,注意分析分子结构是否对称,防止重写、漏写,题目难度中等.

练习册系列答案
相关题目
8. 某同学在试管中用一定量的铁片与足量的稀硫酸反应,得到产生氢气的体积随时间变化的图象(b).若铁的用量不变,改变一个反应条件,得到图象(a).则改变的条件可能是( )
某同学在试管中用一定量的铁片与足量的稀硫酸反应,得到产生氢气的体积随时间变化的图象(b).若铁的用量不变,改变一个反应条件,得到图象(a).则改变的条件可能是( )
 某同学在试管中用一定量的铁片与足量的稀硫酸反应,得到产生氢气的体积随时间变化的图象(b).若铁的用量不变,改变一个反应条件,得到图象(a).则改变的条件可能是( )
某同学在试管中用一定量的铁片与足量的稀硫酸反应,得到产生氢气的体积随时间变化的图象(b).若铁的用量不变,改变一个反应条件,得到图象(a).则改变的条件可能是( )| A. | 向试管中滴加少许硫酸铜溶液 | B. | 在反应过程中对试管加热 | ||
| C. | 用铁粉代替铁片 | D. | 用98%的浓硫酸代替稀硫酸 |
9.X、Y、Z、W、R是短周期中的五种元素,其原子序数依次增大,X、W最外层电子数相等,X为地壳中含量最多的元素,Y是短周期中金属性最强的元素,Z单质是生活应用广泛的常见金属单质,下列说法不正确的是( )
| A. | 原子半径:Y>X | B. | 最高价氧化物的水化物的酸性:R>W | ||
| C. | 气态氢化物的稳定性:X>W | D. | 单质与水(或酸)反应的剧烈程度:Z>Y |
6.下列化学用语正确的是( )
| A. | CH4的比例模型: | B. | 乙醇的结构简式C2H6O | ||
| C. | 乙炔分子式:HC≡CH | D. | 丙酸的键线式: |
13.下列有机反应类型判断不正确的是( )
| A. | ClCH2CH2Cl+2CH3NH2→CH3NHCH2CH2NHCH3+2HCl 取代反应 | |
| B. |  +CH${\;}_{{\;}_{3}}$CH2OH→ +CH${\;}_{{\;}_{3}}$CH2OH→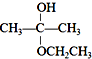 加成反应 加成反应 | |
| C. | HOCH2CH2CH2OH$\stackrel{浓硫酸}{→}$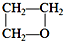 +H2O消去反应 +H2O消去反应 | |
| D. | nCH2=O$\stackrel{一定条件}{→}$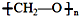 加聚反应 加聚反应 |
3.甲~辛等元素在周期表中的位置如下表所示.下列说法正确的是( )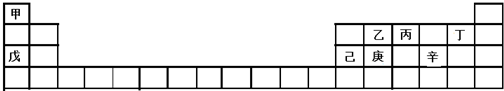

| A. | 甲、戊、己的单质都是金属 | |
| B. | 乙、丙、丁的氢化物稳定性依次增强 | |
| C. | 庚的氧化物不能和丁的氢化物反应 | |
| D. | 己的氧化物能分别与戊和辛的最高价氧化物的水化物反应 |
10.下表中,对有关除杂的方法不正确的是( )
| 物质 | 杂质 | 方法 | |
| A | 乙烷 | 乙烯 | 一定条件下与H2反应使乙烯转化为乙烷 |
| B | 乙炔 | H2S | 通入CuSO4溶液的洗气瓶洗气 |
| C | 溴苯 | Br2 | 加NaOH溶液后分液 |
| D | 工业酒精 | H2O(转为无水酒精) | 加入生石灰,蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
7.现有部分短周期元素的性质或原子结构如表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C,在周期表中的位置是第二周期 IVA族.
(2)元素Y与氢元素形成一种离子YH4+,写出该离子与Z离子形成化合物的电子式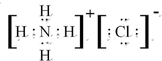 .
.
(3)写出元素X、T形成的化合物XT2的电子式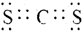 .
.
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b、d、e(填序号)
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.与铁加热,Z生成三价铁,T生成二价铁
e.T原子与Z原子电子层数相同,Z原子半径小于T原子
(5)T的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为SO2+Cl2+2H2O=2HCl+H2SO4
(6)分别用电子式表示Z与镁元素、Y与氮元素形成化合物的过程: ,
,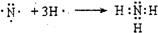 .
.
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子数比内层电子总数少4 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 与氢形成的气态化合物在标准状况下的密度为0.76g•L-1 |
| Z | 元素最高正价与负价的绝对值之差是6 |
(2)元素Y与氢元素形成一种离子YH4+,写出该离子与Z离子形成化合物的电子式
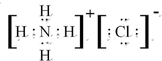 .
.(3)写出元素X、T形成的化合物XT2的电子式
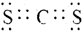 .
.(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b、d、e(填序号)
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.与铁加热,Z生成三价铁,T生成二价铁
e.T原子与Z原子电子层数相同,Z原子半径小于T原子
(5)T的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为SO2+Cl2+2H2O=2HCl+H2SO4
(6)分别用电子式表示Z与镁元素、Y与氮元素形成化合物的过程:
 ,
,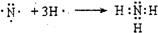 .
.