题目内容
下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A、它们的电子层数依次增多 |
| B、单质的活泼性依次减弱 |
| C、它们的氢化物的稳定性依次增强 |
| D、单质的颜色依次加深 |
考点:卤素原子结构及其性质的比较
专题:元素周期律与元素周期表专题
分析:A、同主族,从上到下,元素原子的电子层数依次增多;
B、同主族,从上到下,单质的氧化性逐渐减弱;
C、同主族,从上到下,元素氢化物的稳定性逐渐减弱;
D、卤素单质的颜色从上到下逐渐加深.
B、同主族,从上到下,单质的氧化性逐渐减弱;
C、同主族,从上到下,元素氢化物的稳定性逐渐减弱;
D、卤素单质的颜色从上到下逐渐加深.
解答:
解:A、F、Cl、Br、I的原子核外电子层数随核电核数的增加而增多,故A正确;
B、F、Cl、Br、I的核电核数逐渐增多,单质的氧化性逐渐减弱,故B正确;
C、按照F、Cl、Br、I的顺序,核电核数逐渐增加,它们的氢化物的稳定性逐渐减弱,故C错误;
D、F2、Cl2、Br2、I2单质的颜色分别是浅黄绿色、黄绿色、深红棕色和紫黑色,即其颜色逐渐加深,故D正确.
故选C.
B、F、Cl、Br、I的核电核数逐渐增多,单质的氧化性逐渐减弱,故B正确;
C、按照F、Cl、Br、I的顺序,核电核数逐渐增加,它们的氢化物的稳定性逐渐减弱,故C错误;
D、F2、Cl2、Br2、I2单质的颜色分别是浅黄绿色、黄绿色、深红棕色和紫黑色,即其颜色逐渐加深,故D正确.
故选C.
点评:本题结合卤族元素考查学生元素周期律的知识,可以根据教材知识来回答,难度不大.

练习册系列答案
相关题目
下列对于乙烯(CH2=CH2)分子结构的描述中正确的是( )
| A、有6个σ键、0个π键 |
| B、3个sp3杂化轨道形成σ键、1个sp3杂化轨道形成π键 |
| C、C-H之间是s轨道与sp2轨道形成的σ键,C与C之间是未参加杂化的2p轨道形成的σ键和π键 |
| D、C与C之间是sp2杂化轨道形成的一个σ键和未参加杂化的2p轨道形成的π键 |
间甲乙苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有(不考虑立体异构)( )
| A、9种 | B、12种 |
| C、15种 | D、20种 |
在同温同压下,下列各组热化学方程式中 Q2>Q1的是( )
| A、2H2(g)+02(g)=2H20(g);△H1=-Q1 2H2(g)+02(g)=2H20(1);△H2=-Q2 | ||||
| B、S(g)+O2(g)=S02(g);△H1=-Q1 S(s)+02(g)=S02(g);△H2=-Q2 | ||||
C、C(s)+
C(s)+02(g)=C02(g);△H2=-Q2 | ||||
D、H2(g)+Cl2(g)=2HCl(g);△H1=-Q1
|
对于常温下pH为1的H2SO4溶液,下列叙述正确的是( )
| A、该溶液1mL稀释至100mL后,pH等于2 |
| B、向该溶液中加入等体积、pH为13的NaOH溶液恰好完全中和 |
| C、该溶液中H2SO4电离出的c(H+)与水电离出的c(H+)之比为10-12 |
| D、1L该溶液中含有H2SO4分子的物质的量为0.05mol |
下列说法正确的是(设阿伏加德罗常数的数值为6.02×1023)( )
| A、在标准状况下,22.4L苯所含分子数目为6.02×1023 |
| B、1mol/LK2SO4溶液所含K+数目为6.02×1023 |
| C、2g氢气所含的原子数为NA |
| D、在常温常压下,16gO2和O3的混合气体所含原子数目为6.02×1023 |
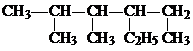 的名称是
的名称是 化合物A中含氧官能团的名称
化合物A中含氧官能团的名称