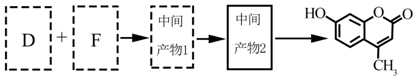
题目内容
1.短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外电子数之和为21.下列关系正确的是( )| W | X | |||
| Y | Z |
| A. | 氢化物沸点:W<Z | B. | 氧化物对应水化物的酸性:Y>W | ||
| C. | 化合物熔点:Y2X3<YZ3 | D. | 简单离子的半径:Y<X |
分析 由元素在周期表中的位置可知W、X为第二周期,Y、Z为第三周期,设Y的最外层电子数为n,则W的最外层电子数为n+2、X的最外层电子数为n+3、Z的最外层电子数为n+4,则n+n+2+n+3+n+4=21,4n=12,n=3,则Y为Al元素,W为N元素,X为O元素,Z为Cl元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答 解:由以上分析可知X为O、Y为Al、Z为Cl、W为N元素,
A.W为N元素,对应的氢化物分子之间可形成氢键,沸点比HCl高,故A错误;
B.Y为Al,对应的氧化物的水化物呈碱性,W为N,对应的氧化物的水化物溶液呈酸性,故B错误;
C.Al2O3离子化合物,AlCl3为共价化合物,则离子化合物的熔点较高,故C错误;
D.X为O、Y为Al,对应的离子具有相同的核外电子排布,核电荷数越大离子半径越小,故D正确.
故选D.
点评 本题考查位置结构性质关系应用,为高考常见题型和高频考点,侧重考查学生的分析能力,元素的相对位置以及核外最外层电子的关系是解答本题的突破口,明确短周期及元素在周期表中的位置来推断,注意基础知识的理解掌握,难度不大.

练习册系列答案
相关题目
12.背景材料:
①“神舟六号”的防护层由聚四氟乙烯和玻璃纤维布组合而成;
②光化学烟雾是导致珠三角地区空气质量下降的重要原因;
③近期,某市举行“液氯泄漏”预警演习;
④据湖北省环境质最监测所抽査显示,新装修住房甲醛含量7成超标.
⑤在广东、香港海域,渤海湾均出现过大面积的赤潮.据此判断,下列说法正确的是
(1)“神舟六号”的防护层是复合材料,四氟乙烯属于不饱和烃.
(2)光化学污染主要是由氮氧化物和碳氢化物引起的.
(3)发生“液氯泄漏”时,应疏导群众立即逆风向高处远离出事地点
(4)为降低甲醛含量,新装修住房应紧闭门窗,并放置一盆水
(5)赤潮是指在一定条件下海洋中某些生物短时间内大量繁殖或聚集,使海水变红色、褐色的现象( )
①“神舟六号”的防护层由聚四氟乙烯和玻璃纤维布组合而成;
②光化学烟雾是导致珠三角地区空气质量下降的重要原因;
③近期,某市举行“液氯泄漏”预警演习;
④据湖北省环境质最监测所抽査显示,新装修住房甲醛含量7成超标.
⑤在广东、香港海域,渤海湾均出现过大面积的赤潮.据此判断,下列说法正确的是
(1)“神舟六号”的防护层是复合材料,四氟乙烯属于不饱和烃.
(2)光化学污染主要是由氮氧化物和碳氢化物引起的.
(3)发生“液氯泄漏”时,应疏导群众立即逆风向高处远离出事地点
(4)为降低甲醛含量,新装修住房应紧闭门窗,并放置一盆水
(5)赤潮是指在一定条件下海洋中某些生物短时间内大量繁殖或聚集,使海水变红色、褐色的现象( )
| A. | (1)(2)(3) | B. | (1)(2)(5) | C. | (2)(3)(5) | D. | (2)(4)(5) |
9.下列指定反应的离子方程式正确的是( )
| A. | Cl2通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 将铜丝插入浓硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 将过氧化钠投入足量水中:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| D. | (NH4)2Fe(SO4)2溶液与过量Ba(OH)2溶液混合:Fe2++2SO42-+2Ba2++2OH-═Fe(OH)2↓+2BaSO4↓ |
16.由下列实验及现象不能推出相应结论的是( )
| 实验 | 现象 | 结论 | |
| A. | 向2 mL 0.1FeCl 3的溶液中加足量铁粉,震荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C. | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D. | 向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
4.在给定条件下,下列选项所示的物质间转化均能实现的是( )
| A. | Fe$→_{点燃}^{Cl_{2}}$FeCl2$\stackrel{NaOH(ap)}{→}$Fe(OH)2 | |
| B. | S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | CaCO3$\stackrel{高温}{→}$CaO$→_{高温}^{SiO_{2}}$CaSiO3 | |
| D. | NH3$→_{催化剂、△}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 |
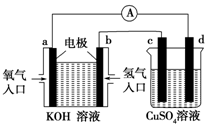 (1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,①试写出S2Cl2的电子式
(1)用作橡胶工业的硫化剂S2Cl2的分子结构中每个原子均满足8电子稳定结构,①试写出S2Cl2的电子式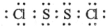 .
. 某实验小组设计如下流程,模拟将汽车尾气中的氮氧化物(主要为NO和NO2的混合物)转化为工业用盐亚硝酸钠(NaNO2),并对亚硝酸钠进行多角度探究:汽车尾气$→_{操作①}^{20%NaOH}$溶液$\stackrel{操作②}{→}$固体$→_{③}^{操作}$NaNO2
某实验小组设计如下流程,模拟将汽车尾气中的氮氧化物(主要为NO和NO2的混合物)转化为工业用盐亚硝酸钠(NaNO2),并对亚硝酸钠进行多角度探究:汽车尾气$→_{操作①}^{20%NaOH}$溶液$\stackrel{操作②}{→}$固体$→_{③}^{操作}$NaNO2
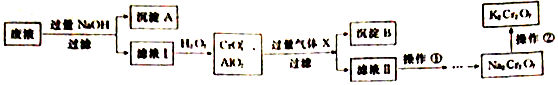
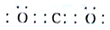 (填电子式)
(填电子式)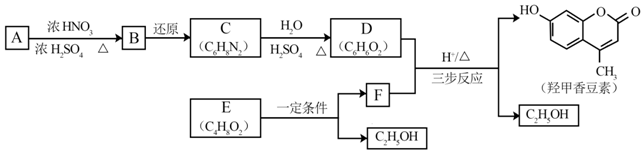
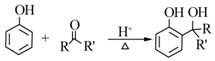
 .B中所含的官能团是硝基.
.B中所含的官能团是硝基.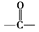 和
和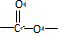 .
.