题目内容
7.磷是生物体中不可缺少的元素之一,在自然界中磷总以磷酸盐的形式存在.(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为1531P
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O1010C+P4O10═P4+10CO
上述反应的各种物质中,属于酸性氧化物的是SiO2、P4O10
(3)白磷有剧毒,不慎沾到皮肤上,可用硫酸铜溶液冲洗解毒.白磷与热的硫酸铜溶液反应生成磷化亚铜,与冷的溶液析出铜,反应方程式为(未配平)
①P4+CuSO4+H2O-→Cu3P+H3PO4+H2SO4
②P4+CuSO4+H2O-→Cu+H3PO4+H2SO4
反应①中,氧化剂为CuSO4、P4,若上述两反应中被氧化的P4的物质的量相等,则消耗的CuSO4的物质的量之比为1:1.
分析 (1)P的质子数为15,中子数比质子数多1,则中子数为16,质量数为31;
(2)酸性氧化物与碱反应生成盐和水,且只有两种元素的氧化物;
(3)含化合价降低元素的反应物是氧化剂,结合电子守恒来计算消耗的CuSO4的物质的量之比.
解答 解:(1)P的质子数为15,中子数比质子数多1,则中子数为16,质量数为31,该原子符合为1531P,故答案为:1531P;
(2)能和碱反应生成盐和水的氧化物是酸性氧化物,所以属于酸性氧化物的是SiO2、P4O10,故答案为:SiO2、P4O10;
(3)反应①中,硫酸铜中铜的化合价从+2价降低到+1价,得到电子,被还原,发生还原反应,因此硫酸铜是氧化剂.另外P元素的化合价从0价部分降低到-3价,得到电子,可知白磷也是氧化剂;如果被氧化的白磷都是1mol,则反应中转移电子是20mol,所以根据电子的得失守恒可知,反应①中需要硫酸铜是$\frac{20}{6}$×3=10mol.而在反应②需要硫酸铜是20×1$\frac{1}{2}$=10mol,所以消耗的CuSO4的物质的量之比为1:1,故答案为:CuSO4、P4;1:1.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,把握电子守恒及反应中的物质的量关系为解答该题的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.最近美国宇航局马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”--全氟丙烷(C3F8),并提出用其“温室化火星”使火星成为第二个地球的计划.下列有关全氟丙烷的说法正确的是( )
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 分子中三个碳原子以单键结合成链状 | |
| C. | C3F8与C3H8互为同分异构体 | |
| D. | 全氟丙烷的电子式为 |
15.下列叙述正确的是( )
| A. | 甲苯能使酸性高锰酸钾溶液和溴水因发生化学反应而褪色 | |
| B. | 不慎把苯酚溶液沾到了皮肤上,应立即用大量水冲洗 | |
| C. | 配制银氨时,应将大量浓氨水一次性加入到少量硝酸银溶液中 | |
| D. | 用银氨溶液或新制氢氧化铜来检验醛或酮时,均只需要水浴加热 | |
| E. | 配制氢氧化铜悬浊液时,应将少量硫酸铜溶液加入到过量的氢氧化钠溶液中 |
16.下列说法正确的是( )
| A. | 氯气和氯离子都呈黄绿色 | |
| B. | 干燥的氯气和新制氯水都能使鲜艳的干红花褪色 | |
| C. | 常温下,液氯可以用钢瓶盛装 | |
| D. | 新制的氯水应该保存在无色的玻璃试剂瓶中 |
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: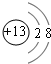 .
.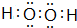 .离子半径T3+<R3-(填“>”、“<”、“=”)
.离子半径T3+<R3-(填“>”、“<”、“=”)
 ;
; ;
; .
.