题目内容
标况下,等质量的CH4和CO2比较,下列说法中不正确的是( )
| A、分子数之比为4:11 |
| B、体积比为11:4 |
| C、物质的量之比为11:4 |
| D、密度比为4:11 |
考点:物质的量的相关计算
专题:计算题
分析:根据n=
=
=
结合ρ=
计算.
| m |
| M |
| N |
| NA |
| V |
| Vm |
| M |
| Vm |
解答:
解:设质量都为1g,则n(CH4)=
mol,n(CO2)=
mol,
A.分子数之比等于物质的量之比,为
mol:
mol=11:4,故A错误;
B.由V=nVm可知,体积比等于物质的量之比,为11:4,故B正确;
C.物质的量之比为
mol:
mol=11:4,故C正确;
D.由ρ=
可知,密度之比等于摩尔质量之比,为4:11,故D正确.
故选A.
| 1 |
| 16 |
| 1 |
| 44 |
A.分子数之比等于物质的量之比,为
| 1 |
| 16 |
| 1 |
| 44 |
B.由V=nVm可知,体积比等于物质的量之比,为11:4,故B正确;
C.物质的量之比为
| 1 |
| 16 |
| 1 |
| 44 |
D.由ρ=
| M |
| Vm |
故选A.
点评:本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
M、N为短周期的两种元素,M元素原子的最外层电子数≤4,N元素原子的最外层电子数>4,下列对其中说法正确的是( )
| A、M、N可能为金属 |
| B、若M、N为同周期元素,则原子半径M<N |
| C、M、N元素的单质可能与水发生置换反应 |
| D、M、N形成的离子化合物不能体现强氧化性 |
在298K下,铅室法生产硫酸存在如下三个平衡:下列有关说法正确的是( )
①SO2(g)+NO2(g)?SO3(g)+NO(g)△H1=-10.0kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H2=-27.3kJ?mol-1
③2SO2(g)+O2(g)?2SO3(g)△H3.
①SO2(g)+NO2(g)?SO3(g)+NO(g)△H1=-10.0kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H2=-27.3kJ?mol-1
③2SO2(g)+O2(g)?2SO3(g)△H3.
| A、298K,反应③的△H3═+47.3 kJ?mol-1 |
| B、平衡时,其他条件不变,升高温度,反应①中正反应速率加快 |
| C、平衡时,其他条件不变,增大NO2浓度可增大反应③中SO2转化率 |
| D、反应③中,每有1mol O=O键断裂,同时生成2molSO3,则该反应达平衡状态 |
氢化钠(NaH)化合物中钠元素是+1价,NaH跟水反应放出H2,下列叙述正确的是( )
| A、在NaH中的氢离子半径比锂离子半径大 |
| B、在NaH中的氢离子的电子层排布与氦原子不相同 |
| C、NaH跟水反应后溶液呈酸性 |
| D、NaH中的氢离子被还原成氢气 |
12.8g铜跟适量的浓硝酸反应,铜完全作用后,共收集到气体5.6L(标准状况),反应消耗HNO3的物质的量可能是( )
| A、0.25mol |
| B、1.0mol |
| C、0.65mol |
| D、0.5mol |
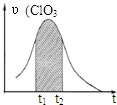 KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图.下列说法正确的( )
KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图.下列说法正确的( )| A、反应开始时速率增大可能是c(H+)所致 |
| B、纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合 |
| C、后期速率υ下降的主要原因是反应向逆反应方向进行 |
| D、图中阴影“面积”可以表示t1-t2时间内c(Cl-)增加量 |
下列物质的熔点高低顺序正确的是( )
| A、金刚石>碳化硅>晶体硅 |
| B、氧化铝>氯化钾>氯化钠 |
| C、H2O>NH3>PH3>AsH3 |
| D、SiC>生铁>纯铁>Mg |