题目内容
20. 有I-IV四个体积均为0.5L的恒容密闭容器,在I、II、III中按不同投料比(Z)充入 HCl和O2(如表),加入催化剂发生反应4HCl(g)+O2(g)?2Cl2 (g)+2H2O(g)△H,HCl的平衡转化率与Z和T的关系如图所示:下列说法不正确的是( )
有I-IV四个体积均为0.5L的恒容密闭容器,在I、II、III中按不同投料比(Z)充入 HCl和O2(如表),加入催化剂发生反应4HCl(g)+O2(g)?2Cl2 (g)+2H2O(g)△H,HCl的平衡转化率与Z和T的关系如图所示:下列说法不正确的是( )| 容器 | 起始时 | ||
| T/℃ | n(HCl)/mol | Z | |
| Ⅰ | 300℃ | 0.25 | a |
| Ⅱ | 300℃ | 0.25 | b |
| Ⅲ | 300℃ | 0.25 | 4 |
| A. | △H<0,a<4<b | |
| B. | 容器III某时刻处R点,则R点的v(正)<v(逆),压强:P(R)>P(Q) | |
| C. | 300℃该反应的平衡常数的值为640 | |
| D. | 若起始时,在容器Ⅳ中只充入0.25molCl2和0.25molH2O(g),300℃达平衡时容器中 HCl的物质的 量浓度大于0.2mol•L-1 |
分析 A.图象分析随温度升高,HC\L转化率减小,说明升温平衡逆向进行;
B.容器III,Z为4,平衡转化率80%,R点为达到平衡状态,反应正向进行,此时压强大于平衡状态下的压强;
C.依据Ⅲ中数据计算平衡浓度,计算平衡常数K=$\frac{生成物平衡浓度的幂次方乘积}{反应物平衡浓度的幂次方乘积}$;
D.计算起始量氯化氢和氧气物质的量之比来分析判断.
解答 解:A.图象中HCl转化率随温度升高减小,升温平衡逆向进行,正反应为放热反应△H<0,氧气越大HC\l转化率越大,相同温度下投料比a<4<b,故A正确;
B.容器III,Z为4,平衡转化率80%,R点为达到平衡状态,反应正向进行,则R点的v(正)>v(逆),此时压强大于平衡状态下的压强压强:P(R)>P(Q),故B错误;
C.结合三行计算列式 $\frac{n(HCl)}{n({O}_{2})}$=4,n(HCl)=0.25mol,n(O2)=0.0625mol,体积为0.5L,c(HCl)=0.5mol/L,n(O2)=0.125mol/L,二氧化碳转化率80%,
4HCl(g)+O2(g)?2Cl2 (g)+2H2O(g)
起始量(mol/L) 0.5 0.125 0 0
变化量(mol/L)0.5×80%=0.4 0.1 0.2 0.2
平衡量(mol/L) 0.1 0.025 0.2 0.2
K=$\frac{0.{2}^{2}×0.{2}^{2}}{0.{1}^{4}×0.025}$=640,故C正确;
D.若起始时,在容器Ⅳ中只充入0.25molCl2和0.25moIH2O(g),
4HCl(g)+O2(g)?2Cl2 (g)+2H2O(g)
起始量(mol) 0 0 0.25 0.25
0.5 0.125 0 0
$\frac{n(HCl)}{n({O}_{2})}$=$\frac{0.5}{0.125}$=4,依据C计算分析可知,Ⅳ和Ⅲ达到相同的平衡状态,达平衡时容器中 HCl的物质的量浓度0.1mol/L,故D错误;
故选BD.
点评 本题考查了起始量不同对化学反应平衡的影响、平衡三行计算和平衡常数计算、反应进行的方向的判断方法,掌握基础是解题关键,题目难度中等.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案| A. | 滴加石蕊显红色的溶液:K+、N${H}_{4}^{+}$、Cl-、S${O}_{4}^{2-}$ | |
| B. | 加铝粉能放出氢气的溶液:Na+、N${O}_{3}^{-}$、Cl-、Ba2+ | |
| C. | 使红色石蕊试纸变蓝色的溶液:Na+、Al3+、Cl-、HC${O}_{3}^{-}$ | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1013的溶液:Fe2+、Cl-、Mn${O}_{4}^{-}$、S${O}_{4}^{2-}$ |
(一)制备苯乙烯(原理如反应I所示):
Ⅰ.
 (g)?
(g)? (g)+H2 △H=+124KJ•mol-1
(g)+H2 △H=+124KJ•mol-1(1)部分化学键的键能如表所示:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/KJ/mol | 412 | 348 | X | 436 |
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.请用化学平衡理论解释通入水蒸气的原因:正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率.
(3)已知吉布斯自由能△G=△H-T△S,当△G<0时反应可自发进行.由此判断反应I在高温(填“高温”或“低温”)更易自发进行.
(二)制备α-氯乙基苯(原理如反应Ⅱ所示):
Ⅱ.
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(G)△H2>0
(g)+HCl(G)△H2>0(4)T°C时,向10L恒容密闭容器中充入2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,乙苯(或Cl2)、α-氯乙基苯(或HCl)的物质的量浓度(c)随时间(t)变化的曲线如图所示:

①0-2min内,以HCl表示的该反应速率v(HCI)=0.05 mol•L-1•min-1.
②6min时,改变的外界条件为升高温度,该条件下的平衡常数K的数值=16.
③10min时,保持其他条件不变,再向容器中充入1mol乙苯、1mol Cl2、1molα-氯乙基苯和1mol HCl,则此时该反应v正>v逆(填“>”、“<”或“=”);若12min时反应再次达到平衡,则在0-12min内,Cl2的转化率α=86.7%.(计算结果保留三位有效数字)
| A. | 用分液漏斗分离硬脂酸钠与甘油的混合物 | |
| B. | 容量瓶用蒸馏水洗涤后须烘干才能使用 | |
| C. | 分馏石油时,温度计的水银球必须插入液面以下 | |
| D. | 氯化钠溶液蒸发结晶时,蒸发皿中有大量晶体析出并剩余少量溶液时应停止加热 |

| A. | 1种 | B. | 4种 | C. | 3种 | D. | 2种 |
 连二次硝酸(H2N2O2)是一种二元酸,常温下,用0.01mol•L-1的NaOH溶液滴定10mL0.01mol•L-1 H2N2O2溶液,溶液pH随加入NaOH溶液体积的变化如图所示,下列有关说法中正确的是( )
连二次硝酸(H2N2O2)是一种二元酸,常温下,用0.01mol•L-1的NaOH溶液滴定10mL0.01mol•L-1 H2N2O2溶液,溶液pH随加入NaOH溶液体积的变化如图所示,下列有关说法中正确的是( )| A. | H2N2O2在水溶液中的电离方程式为H2N2O2═2H++N2O22- | |
| B. | 该滴定过程应该选择甲基橙作为指示剂 | |
| C. | a点的溶液中:c(Na+)+c(H+)═c(OH-)+c(N2O22-)+c(H N2O2-) | |
| D. | b点的溶液中:c(Na+)>c(H N2O2-)>c(OH-)>c(H2N2O2)>c(N2O22-) |

 A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期.B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子.请回答下列问题:
A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期.B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子.请回答下列问题: ,F基态原子的外围电子排布式3d104s1.
,F基态原子的外围电子排布式3d104s1.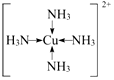 (用元素符号表示).
(用元素符号表示).