题目内容
13.医用麻醉药苄佐卡因E和食品防腐剂J的合成路线如图1:
已知:
I.M代表E分子结构中的一部分
II.
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$
请回答下列问题:
(1)芳香烃A的质谱图如2图,其名称是甲苯.
(2)E中所含官能团的名称是氨基、酯基.
(3)由A制备F的反应类型是取代反应.
(4)C能与NaHCO3溶液反应,反应①的化学方程式是
 .
.(5)反应②中试剂ⅱ是a(填序号)
a.高锰酸钾酸性溶液 b.氢氧化钠溶液
(6)写出反应③的化学反应方程式
(7)J有多种同分异构体,写出其中所有符合下列条件的结构简式
 .
.a.为苯的邻位二元取代物,且与FeCl3可以发生显色反应
b.与J具有相同的官能团,且能发生银镜反应
(8)以A为起始原料,选用必要的无机试剂合成涂改液的主要成分亚甲基环己烷(
 ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
分析 分析流程,突破口为F(C7H7Cl),先分析下面一条流程,A为芳香烃,在Cl2/FeCl3条件下发生苯环上的卤代生成F,则A应为C7H8,所以A为 ,F为
,F为 ,J中含有酯基,为羧基与羟基反应而来,表明流程中反应会生成羧基,则试剂ii为酸性高锰酸钾溶液,甲基被反应为羧基,则G为
,J中含有酯基,为羧基与羟基反应而来,表明流程中反应会生成羧基,则试剂ii为酸性高锰酸钾溶液,甲基被反应为羧基,则G为 ,J中含有酚羟基,应由Cl为-OH取代得到,则试iii为氢氧化钠溶液,则H为
,J中含有酚羟基,应由Cl为-OH取代得到,则试iii为氢氧化钠溶液,则H为 ,经过酸化,得到I,则I为
,经过酸化,得到I,则I为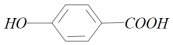 ,在试剂i中加热,发生酯化反应,生成J,则试剂i为CH3CH2OH;再分析上面一条流程,A在浓硝酸,浓硫酸加热条件下,发生硝化反应,在对位,则B为
,在试剂i中加热,发生酯化反应,生成J,则试剂i为CH3CH2OH;再分析上面一条流程,A在浓硝酸,浓硫酸加热条件下,发生硝化反应,在对位,则B为 ,经过酸性高锰酸钾溶液反应,生成羧酸,则C为
,经过酸性高锰酸钾溶液反应,生成羧酸,则C为 ,在试剂i,即CH3CH2OH发生酯化反应,生成D,则D为
,在试剂i,即CH3CH2OH发生酯化反应,生成D,则D为 ,硝基在Fe/HCl作用下,被还原为-NH2,则E为
,硝基在Fe/HCl作用下,被还原为-NH2,则E为 ,据此分析解答.
,据此分析解答.
解答 解:A: ,B:
,B: ,C:
,C: ,D:
,D: ,E:
,E: ,F:
,F: ,G:
,G: ,H:
,H: ,I:
,I: ,试剂i:CH3CH2OH,试剂ii:酸性高锰酸钾溶液,试剂iii:NaOH溶液.
,试剂i:CH3CH2OH,试剂ii:酸性高锰酸钾溶液,试剂iii:NaOH溶液.
(1)A属于芳香烃,其结构简式是 ,其名称为甲苯,
,其名称为甲苯,
故答案为:甲苯;
(2)E为: ,其中含有的官能团为-NH2,-COO-,其名称分别为:氨基、酯基,
,其中含有的官能团为-NH2,-COO-,其名称分别为:氨基、酯基,
故答案为:氨基、酯基;
(3)由A→F,即由 →
→ ,苯环上的氢被氯原子取代,则反应类型为取代反应,故答案为:取代反应;
,苯环上的氢被氯原子取代,则反应类型为取代反应,故答案为:取代反应;
(4)C为: ,能与NaHCO3溶液反应,反应①为C与CH3CH2OH发生酯化反应,生成
,能与NaHCO3溶液反应,反应①为C与CH3CH2OH发生酯化反应,生成 ,则反应方程式为:
,则反应方程式为: ,
,
故答案为: ;
;
(5)反应②中试剂ii是酸性高锰酸钾溶液,故a正确;故答案为:a;
(6)反应③是 在加热条件下,在NaOH溶液中水解,反应的化学方程式为
在加热条件下,在NaOH溶液中水解,反应的化学方程式为,
故答案为:;
(7)J为: ,有多种同分异构体,其中符合a.为苯的二元取代物,其中一个取代基为羟基 b.与J具有相同的官能团,且能发生银镜反应的同分异构体有:
,有多种同分异构体,其中符合a.为苯的二元取代物,其中一个取代基为羟基 b.与J具有相同的官能团,且能发生银镜反应的同分异构体有:
,共有6种,
故答案为: ;
;
(8)A为: ,以A为起始原料,选用必要的无机试剂合成涂改液的主要成分亚甲基环己烷(
,以A为起始原料,选用必要的无机试剂合成涂改液的主要成分亚甲基环己烷( ),可考虑如下流程:
),可考虑如下流程: ,
,
故答案为: .
.
点评 本题主要考察有机合成与推断,需要掌握常见的有机反应,并能灵活运用,仔细分析流程图是解答的关键.本题难度中等,是中档题.

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案| A. | 某化合物在熔融态能导电,则该物质中一定含有离子键,可能含有共价键 | |
| B. | 冰是分子晶体,受热分解的过程中,只需克服分子间的作用力 | |
| C. | 某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键 | |
| D. | 化学变化中往往伴随着化学键的破坏与形成,物理变化中一定没有化学键的破坏或形成 |
(一)制备苯乙烯(原理如反应I所示):
Ⅰ.
 (g)?
(g)? (g)+H2 △H=+124KJ•mol-1
(g)+H2 △H=+124KJ•mol-1(1)部分化学键的键能如表所示:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/KJ/mol | 412 | 348 | X | 436 |
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气.请用化学平衡理论解释通入水蒸气的原因:正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率.
(3)已知吉布斯自由能△G=△H-T△S,当△G<0时反应可自发进行.由此判断反应I在高温(填“高温”或“低温”)更易自发进行.
(二)制备α-氯乙基苯(原理如反应Ⅱ所示):
Ⅱ.
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(G)△H2>0
(g)+HCl(G)△H2>0(4)T°C时,向10L恒容密闭容器中充入2mol乙苯(g)和2mol Cl2(g)发生反应Ⅱ,乙苯(或Cl2)、α-氯乙基苯(或HCl)的物质的量浓度(c)随时间(t)变化的曲线如图所示:

①0-2min内,以HCl表示的该反应速率v(HCI)=0.05 mol•L-1•min-1.
②6min时,改变的外界条件为升高温度,该条件下的平衡常数K的数值=16.
③10min时,保持其他条件不变,再向容器中充入1mol乙苯、1mol Cl2、1molα-氯乙基苯和1mol HCl,则此时该反应v正>v逆(填“>”、“<”或“=”);若12min时反应再次达到平衡,则在0-12min内,Cl2的转化率α=86.7%.(计算结果保留三位有效数字)
| A. |  可用于吸收NH3或HCl,并防止倒吸 | |
| B. |  蒸馏时的接收装置 | |
| C. |  除去SO2中的少量HCl | |
| D. |  准确量取一定体积K2Cr2O7标准溶液 |
 下列有关它的叙述不正确的是( )
下列有关它的叙述不正确的是( )| A. | 能溶于热水 | |
| B. | 在人体内能水解 | |
| C. | 1 mol对乙酰氨基酚与溴水反应时最多消耗Br22mol | |
| D. | 与对硝基乙苯互为同系物 |
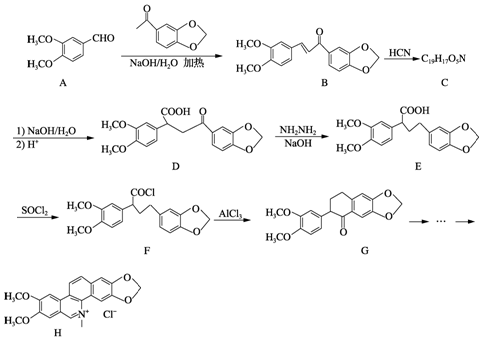
 ;由E→F的反应类型为取代.
;由E→F的反应类型为取代. .
. ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
 +CH3Cl$\stackrel{AlCl_{3}}{→}$
+CH3Cl$\stackrel{AlCl_{3}}{→}$ +HCl
+HCl .
. .
. .
. .
. A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期.B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子.请回答下列问题:
A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期.B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子.请回答下列问题: ,F基态原子的外围电子排布式3d104s1.
,F基态原子的外围电子排布式3d104s1.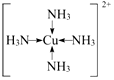 (用元素符号表示).
(用元素符号表示).