题目内容
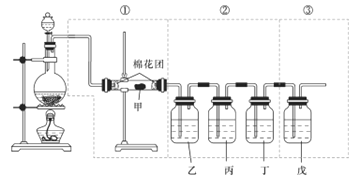
【题目】无水四氯化锡(SnCl4) 实验室可用熔融的锡(熔点为23.9℃)与Cl2反应制备SnCl4,装置如下图所示回答下列问题:

已知SnCl4在湿空气中极易水解生成SnO2·xH2O。
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)a管的作用是________,装置A中发生反应的化学方程式是______________。
(2)装置B、C、F、G中盛放的最佳试剂依次为____________(填序号,试剂可重复使用)。
①饱和Na2CO3溶液 ②NaOH溶液 ③浓H2SO4 ④饱和NaCl溶液 ⑤H2O
(3)点燃酒精灯前需要进行的一步操作是______________。
(4)若撒去装置C,则装置D中可能会发生的主要副反应的化学方程式为___________。
(5)得到的产物中常混有SnCl2,某实验小组用碘氧化法滴定分析产品中SnCl4的含量(Sn2++I2=Sn4++2I-)。准确称取mg产品于锥形瓶中,用少量浓盐酸溶解,再加水稀释,淀粉溶液作指示剂,用0.1mol/L碘标准溶液滴定至终点,达到滴定终点时的现象为________,消耗碘标准溶液20.00mL,计算产品中SnCl4的含量______(用含m的代数式表示)。
【答案】 使装置A中分液漏斗内的液体顺利流下 2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O ④③③② 打开装置A中分液漏斗活塞,使整套装置中充满黄绿色气体Cl2 SnCl4+(x+2)H2O=SnO2·xH2O+4HCl 当滴入最后一滴碘标准溶液时,锥形瓶中溶液无色变为蓝色.且半分钟内不褪色 ![]()
【解析】本题主要考查对于SnCl4的实验室制法的评价。
(1)a管的作用是使装置A中分液漏斗内的液体顺利流下,装置A中发生反应的化学方程式是2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(2)氯气含有浓盐酸挥发的氯化氢杂质,通过B除去氯化氢,SnCl4在湿空气中极易水解生成SnO2·xH2O,氯气通过C干燥,通过F防止水蒸气进入E,氯气有毒,G吸收氯气的余气,所以装置B、C、F、G中盛放的最佳试剂依次为④③③②。
(3)点燃酒精灯前需要进行的一步操作是打开装置A中分液漏斗活塞,使整套装置中充满黄绿色气体Cl2,排出装置中空气,防止Sn 在加热时被空气中氧气氧化。
(4)若撒去装置C,氯气中含有水蒸气,则装置D中可能会发生的主要副反应的化学方程式为SnCl4+(x+2)H2O=SnO2·xH2O+4HCl。
(5)达到滴定终点时的现象为当滴入最后一滴碘标准溶液时,锥形瓶中溶液无色变为蓝色且半分钟内不褪色,SnCl4的含量为(mg-0.1mol/L×20.00mL×180g/mol)/mg=![]() 。
。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】I、三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(1)①为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:适当升高温度,搅拌,______等。
②酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。在沉镍前,需加Na2CO3控制溶液pH范围为______。
(2)“氧化”生成Ni2O3的离子方程式为______。
(3)工业上用镍为阳极,电解0.05 ~ 0.1 mol·L-1 NiCl2 溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如下图所示,则NH4Cl的浓度最好控制为______。

II、煤制天然气的工艺流程简图如下:

(4)已知反应I:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
(5)①甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_____。
②工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是____。
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应:CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的
2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的![]() H=______。
H=______。