题目内容
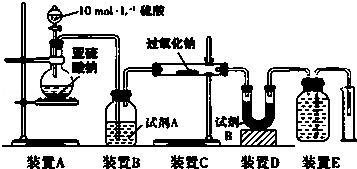
14.为了将混有K2SO4、Mg SO4、CaCl2的KCl固体提纯,并制得纯净的KCl晶体,某同学设计如下实验方案:
(1)操作①⑤⑥的名称依次是溶解,过滤,蒸发.
(2)操作②~④加入溶液后的离子反应方程式分别为Mg2++2OH-=Mg(OH)2↓;Ba2++SO42-=BaSO4↓;Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓.
(3)实验过程中产生的多次沉淀不需要 (填“需要”或“不需要”)多次过滤,理由是生成的沉淀可一次性过滤,如果多次过滤会使过程复杂化.
(4)该同学设计的实验方案不严密 (填“严密”或“不严密”),理由是加硝酸会引入杂质NO3-.该步骤所加试剂应该是盐酸.
分析 由实验流程可知,除去SO42-、Ca2+、Mg2+离子的方法一般是使它们分别形成BaSO4、CaCO3、Mg(OH)2沉淀,所以需要加入稍过量的BaCl2K2CO3、KOH溶液,过量的Ba2+可用K2CO3溶液除去,因此实验时必须先加入Ba(NO3)2溶液,后加入K2CO3溶液,则试剂顺序为BaCl2、KOH、K2CO3或KOH、BaCl2、K2CO3或BaCl2、K2CO3、KOH,操作①为溶解,⑤为过滤,应加稀盐酸调节溶液的pH,否则会引入杂质,⑥为蒸发结晶得到KCl,以此来解答.
解答 解:由实验流程可知,除去SO42-、Ca2+、Mg2+离子的方法一般是使它们分别形成BaSO4、CaCO3、Mg(OH)2沉淀,所以需要加入稍过量的BaCl2K2CO3、KOH溶液,过量的Ba2+可用K2CO3溶液除去,因此实验时必须先加入Ba(NO3)2溶液,后加入K2CO3溶液,则试剂顺序为BaCl2、KOH、K2CO3或KOH、BaCl2、K2CO3或BaCl2、K2CO3、KOH,操作①为溶解,⑤为过滤,应加稀盐酸调节溶液的pH,否则会引入杂质,⑥为蒸发结晶得到KCl,
(1)由上述分析可知,操作①⑤⑥的名称依次是溶解、过滤、蒸发,故答案为:溶解、过滤、蒸发;
(2)操作②~④加入的试剂为KOH、BaCl2、K2CO3,涉及反应的离子方程式为Mg2++2OH-=Mg(OH)2↓、Ba2++SO42-=BaSO4↓、Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓,
故答案为:Mg2++2OH-=Mg(OH)2↓、Ba2++SO42-=BaSO4↓、Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓;
(3)为简化实验操作,可一次性过滤,如果多次过滤会使过程复杂化,则不需要多次过滤,
故答案为:不需要;生成的沉淀可一次性过滤,如果多次过滤会使过程复杂化;
(4)由上述分析可知,不能利用硝酸调节pH,应加盐酸调节pH,除去过量的KOH、K2CO3,则实验不严密,
故答案为:不严密;加硝酸会引入杂质NO3-;盐酸.
点评 本题考查混合物的分离提纯的综合应用,为高频考点,把握流程中的反应、混合物分离方法选择为解答的关键,侧重分析与实验能力的考查,题目难度不大.

| A. | CuSO4只是还原剂 | |
| B. | Cu3P既是氧化产物又是还原产物 | |
| C. | P既是氧化剂又是还原剂 | |
| D. | 若有11 mol P参加反应,转移电子的物质的量为60 mol |
| A. | 液氯 | B. | 干冰 | C. | 海水 | D. | 碳酸钠 |
| A. | 碳酸氢盐 | B. | 电解质 | C. | 钠盐 | D. | 碱性氧化物 |
(2)$\frac{1}{2}$N2 (g)+O2(g)═NO2(g)△H=+33.9kJ/mol
(3)$\frac{1}{2}$N2 (g)+$\frac{3}{2}$H2(g)═NH3(g)△H=-46.0kJ/mol
计算NH3(g)燃烧生成NO2(g)和H2O(g)的燃烧热( )
| A. | 282.8 kJ/mol | B. | -282.8 kJ/mol | C. | 848.4kJ/mol | D. | -848.4 kJ/mol |
| A. | 22.4 L O2中一定含有6.02×1023个氧分子 | |
| B. | 将80 g NaOH 溶于1L 水中,所得溶液中NaOH 的物质的量浓度为2mol/L | |
| C. | 18 g 水在标准状况下的体积为22.4 L | |
| D. | 在标准状况下,20 ml NH3与60 ml O2所含的分子数之比为1:3 |