题目内容
12.短周期元素A、B、C、D的原子序数逐渐增大,A、B的最高正价与最低负价之和都为0,D与A同主族,C的一种单质具有杀菌的作用,少量能使人精神振奋,E的合金是目前使用比较广泛的合金,下列说法正确的是( )| A. | 简单离子的半径:r(A)<r(C)<r(D)<r(E) | |
| B. | 元素B的最简单气态氧化物的稳定性比C的强 | |
| C. | D2C2与A2C2的漂白原理相同 | |
| D. | 元素E的氧化物能溶于B或D的最高价氧化物对应的水化物中 |
分析 短周期元素A、B、C、D的原子序数逐渐增大,C的一种单质具有杀菌的作用,少量能使人精神振奋,且为短周期元素,为O元素;
E的合金是目前使用比较广泛的合金,则E是Fe元素;
A、B元素原子序数都小于O元素,A、B的最高正价与最低负价之和都为0,A原子序数小于B,则A是H元素、B是C元素;
D与A同主族,且原子序数大于O元素,则D是Na元素,
A.电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.Na2O2与H2O2都具有强氧化性,能漂白某些物质;
D.元素Fe的氧化物能溶于强酸.
解答 解:短周期元素A、B、C、D的原子序数逐渐增大,C的一种单质具有杀菌的作用,少量能使人精神振奋,且为短周期元素,为O元素;
E的合金是目前使用比较广泛的合金,则E是Fe元素;
A、B元素原子序数都小于O元素,A、B的最高正价与最低负价之和都为0,A原子序数小于B,则A是H元素、B是C元素;
D与A同主族,且原子序数大于O元素,则D是Na元素,
A.电子层数越多,其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径r(A)<r(D)<r(C)<r(E),故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性C>B,所以元素B的最简单气态氧化物的稳定性比C的弱,故B错误;
C.Na2O2与H2O2都具有强氧化性,能漂白某些物质,其原理都是利用物质的强氧化性,原理相同,故C正确;
D.元素Fe的氧化物能溶于强酸,B的最高价氧化物的水化物是弱酸、D的最高价氧化物的水化物是强碱,Fe的氧化物不能溶于碳酸、氢氧化钠溶液,故D错误;
故选C.
点评 本题考查原子结构和元素周期律,为高考高频点,明确元素周期表结构、物质结构、物质性质是解本题关键,熟练掌握元素周期律,题目难度中等.

 名校课堂系列答案
名校课堂系列答案(1)处理NOx的一种方法是利用氨气非催化还原法将NOx还原为N2.已知还原1molNO约放出451.7kJ的热量,同时生成气态水,则该反应的热化学方程式为4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H=-2710.2kJ•mol-1.
(2)用活性炭还原法处理氮氧化物,其反应为C(s)+2NO(g)?N2(g)+CO2(g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
②根据表中数据,计算T1℃时该反应的平衡常数为K=0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率将不变 (填“增大”、“不变”或“减小”).
④下列各项能作为判断该反应达到平衡的是c、d (填序号字母);
a.容器内压强保持不变
b.2v正(NO)=v逆(N2)
c.容器内CO2的体积分数不变
d.混合气体的密度保持不变
⑤恒温恒容时,30min末改变某一条件,一段时间后反应重新达到平衡,则改变的条件可能是减小CO2的浓度.请在图1中画出30min至40min的变化曲线.
(3)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O═2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
(4)全钒氧化还原液流电池是目前发展势头强劲的优秀绿色环保储能电池.该电池的原理可用如图2所示装置示意,溶液中c(H+)=2.0mol•L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.则该电池充电时b极接直流电源的负极(填“正极”或“负极”),a极的电极反应式为VO2++H2O-e-═VO2++2H+.若假设溶液温度、体积没有变化,则放电时右槽溶液的pH将增大(填“增大”、“减小”或“不变”).

| A. | 研发易降解的生物农药符合十八大报告中提到的生态文明建设 | |
| B. | 熟吃西红柿要比生吃维生素C的损失小 | |
| C. | 教育部发出禁令是因为吸烟也会产生多种有害有毒物质 | |
| D. | 大量焚烧田间秸秆会产生雾霾而影响空气质量 |
 )是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )
)是运载火箭的主体燃料.C2H8N2物质中含碳碳单键的同分异构体共有( )| A. | 2种 | B. | 3 种 | C. | 4种 | D. | 5种 |
| A. | 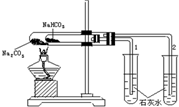 用如图装置比较Na2CO3与NaHCO3的稳定性 | |
| B. |  用如图装置吸收NH3,并防止倒吸 | |
| C. | 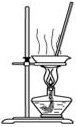 用如图装置蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 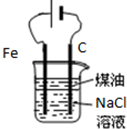 用如图装置制取Fe(OH)2沉淀 |
| A. | 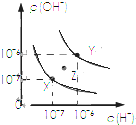 表示不同条件下水的电离平衡曲线,图中各点温度:X>Z>Y | |
| B. | 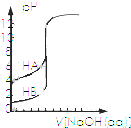 表示浓度相同的两种一元酸分别用0.1 mol/L NaOH溶液滴定曲线,酸性:HA>HB | |
| C. | 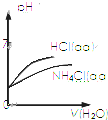 表示pH相同的NH4Cl溶液和HCl溶液分别加同体积水稀释二者pH的变化曲线 | |
| D. | 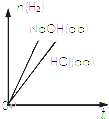 表示向等体积、等物质的量浓度的盐酸和NaOH溶液中分别加入足量铝粉,产生H2的物质的量随时间的变化曲线 |
 周期表中有A、B、C三种原子序数依次增大的元素,A是地壳中含量最多的金属元素,B的价层电子排布为nsn-1npn+1,C是生活中的一种常用金属且其原子的外围电子排布为3d104s1.
周期表中有A、B、C三种原子序数依次增大的元素,A是地壳中含量最多的金属元素,B的价层电子排布为nsn-1npn+1,C是生活中的一种常用金属且其原子的外围电子排布为3d104s1.