题目内容
3.近年来,雾霾频发,重污染天气频现,控制大气污染迫在眉睫.二氧化硫(SO2)和氮氧化物(NOx)等是主要大气污染物,消除大气污染有多种方法.(1)处理NOx的一种方法是利用氨气非催化还原法将NOx还原为N2.已知还原1molNO约放出451.7kJ的热量,同时生成气态水,则该反应的热化学方程式为4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H=-2710.2kJ•mol-1.
(2)用活性炭还原法处理氮氧化物,其反应为C(s)+2NO(g)?N2(g)+CO2(g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
②根据表中数据,计算T1℃时该反应的平衡常数为K=0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率将不变 (填“增大”、“不变”或“减小”).
④下列各项能作为判断该反应达到平衡的是c、d (填序号字母);
a.容器内压强保持不变
b.2v正(NO)=v逆(N2)
c.容器内CO2的体积分数不变
d.混合气体的密度保持不变
⑤恒温恒容时,30min末改变某一条件,一段时间后反应重新达到平衡,则改变的条件可能是减小CO2的浓度.请在图1中画出30min至40min的变化曲线.
(3)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O═2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+.
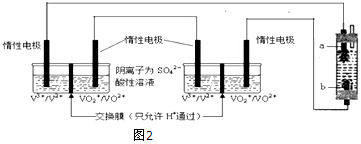
(4)全钒氧化还原液流电池是目前发展势头强劲的优秀绿色环保储能电池.该电池的原理可用如图2所示装置示意,溶液中c(H+)=2.0mol•L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.则该电池充电时b极接直流电源的负极(填“正极”或“负极”),a极的电极反应式为VO2++H2O-e-═VO2++2H+.若假设溶液温度、体积没有变化,则放电时右槽溶液的pH将增大(填“增大”、“减小”或“不变”).

分析 (1)氨气与一氧化氮反应生成氮气和水,依据还原1molNO约放出451.7kJ的热量,结合热化学方程式书写方法写出该反应的热化学方程式;
(2)①根据v=$\frac{△C}{△t}$计算反应速率;
②依据图中数据可知反应进行到20分钟时,反应物、生成物浓度不变,达到平衡状态,根据平衡常数计算平衡常数;
③此反应特点是前后气体分子数不变的反应,增大NO的浓度相当于加压,考虑压强对平衡的影响;
④依据化学平衡状态的实质是正逆反应速率相等,结合反应特征分析判断;
⑤依据图表数据变化分析,30min末一氧化氮和二氧化碳浓度减小,氮气浓度增大,结合计算平衡常数和浓度变化分析判断;改变的条件可能是减小二氧化碳浓度,据此画出图象;
(3)三价铁离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子,已经得失电子守恒写出反应离子方程式;
(4)依据电解池中阳极发生氧化反应,阴极发生还原反应,充电时右槽溶液颜色由绿色变为紫色,则V3+得到电子发生氧化反应变为V2+,左槽电极发生还原反应,VO2++得到电子生成VO2+;
放电时,装置为原电池,右槽a电极为正极,发生还原反应,电极反应式为:VO2++2H++e-=VO2++H2O,消耗氢离子;
解答 解:(1)氨气与一氧化氮反应生成氮气和水,还原1molNO约放出451.7kJ的热量,则消耗6molNO放热的热量为27110.2kJ,则该反应的热化学方程式为:4NH3(g)+6NO (g)=5N2(g)+6H2O(g)△H=-2710.2kJ•mol-1,
故答案为:4NH3(g)+6NO (g)=5N2(g)+6H2O(g)△H=-2710.2kJ•mol-1;
(2)①10min~20min以v(CO2)=$\frac{△C}{△t}$=$\frac{0.09mol/L}{10min}$=0.009mol•(L•min)-1;
故答案为:0.009mol•(L•min)-1;
②依据图中数据可知20分钟后反应达到平衡状态,平衡时各物质浓度,C(NO)=0.40mol•(L•min)-1; C(N2)=0.30mol•(L•min)-1; C(CO2)=0.30mol•(L•min)-1;
平衡常数K=$\frac{C({N}_{2})C(C{O}_{2})}{{C}^{2}(NO)}$=$\frac{0.3×0.3}{0.4×0.4}$=0.56;
故答案为:K=0.56;
③此反应特点是前后气体分子数不变的反应,增大NO的浓度相当于加压,加压对平衡无影响,故NO的转化率不变,
故答案为:不变;
④C(s)+2NO(g)?N2(g)+CO2(g)反应是气体体积不变的反应,
a.反应是气体体积不变的反应,反应过程中和反应平衡状态压强相同,所以容器内压强保持不变不能说明反应达到平衡,故a错误;
b.反应速率之比等于化学方程式系数之比,当v正(NO)=2v逆(N2),反应达到平衡,故b错误;
c.容器内CO2的体积分数不变,说明反应达到平衡,故c正确;
d.混合气体密度等于质量除以体积,反应中碳是固体,平衡移动气体质量变化,体积不变,所以混合气体的密度保持不变,说明反应达到平衡,故d正确;
故选:cd;
⑤30min时改变某一条件,反应重新达到平衡,依据平衡常数计算得到c(N2)=0.34mol/L;c(CO2)=0.17mol/L;c(NO)=0.32mol/L;K=$\frac{C({N}_{2})C(C{O}_{2})}{{C}^{2}(NO)}$=$\frac{0.34×0.17}{0.32×0.32}$=0.56,化学平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以减小二氧化碳浓度,平衡正向进行的结果;依据二氧化碳浓度减小在图象中画出浓度变化如图所示,作图要点:①起点在30min时V逆(CO2)的一半左右;②终点不超过30min时V逆(CO2),则图象为 ,
,
故答案为:减小CO2 的浓度; ;
;
(3)30min时改变某一条件,反应重新达到平衡时c(N2)=0.34mol/L;c(CO2)=0.17mol/L;c(NO)=0.32mol/L;则平衡常数K=$\frac{C({N}_{2})C(C{O}_{2})}{{C}^{2}(NO)}$=$\frac{0.34×0.17}{0.32×0.32}$=0.56,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以减小二氧化碳浓度,平衡正向进行的结果,
故答案为:减小二氧化碳浓度;
(4)充电时右槽溶液颜色由绿色变为紫色,则V3+得到电子发生还原反应变为V2+,电解池中发生氧化反应的一极为阳极,与电源的正极相连,发生还原反应的极为阴极,与电源负极相连,所以b极接直流电源的负极;
a极为阳极,发生氧化反应电极反应式为:VO2++H2O-e-═VO2++2H+;
放电时,装置为原电池,右槽a电极为正极,发生还原反应,电极反应式为:VO2++2H++e-=VO2++H2O,消耗氢离子,溶液的pH值变大;
故答案为:负极;VO2++2H++e-=VO2++H2O;增大.
点评 本题为综合题,考查了热化学方程式的书写、反应速率、平衡常数的计算、化学平衡状态的判断、原电池、电解池工作原理,题目难度较大,熟悉相关知识是解题关键.

 阅读快车系列答案
阅读快车系列答案| A. | 按系统命名法,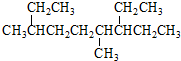 的名称为3,6-二甲基-7-乙基壬烷 的名称为3,6-二甲基-7-乙基壬烷 | |
| B. | 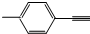 分子中所有原子共平面 分子中所有原子共平面 | |
| C. | 标准状况下,1 L辛烷完全燃烧生成CO28L | |
| D. | 1.0 mol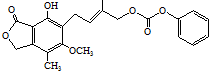 最多能与5.0 mol NaOH水溶液完全反应 最多能与5.0 mol NaOH水溶液完全反应 |
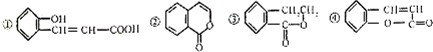
| A. | 只有①能和碳酸钠反应放出气体 | B. | ②和④互为同分异构体 | ||
| C. | ①②④都可以使溴水褪色 | D. | ④与H2加成后可以得到③ |
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |

以下说法正确的是( )
| A. | 白色沉淀甲是Al(OH)3,气体甲是CO2,原混合物中一定含有Al3+和HCO3- | |
| B. | 白色沉淀乙是BaSO4,原混合物中一定含有SO42- | |
| C. | 气体乙一定是NO和NO2的混合气体 | |
| D. | 原混合物中一定含有Na+、Al3+、NO3-、SO32- |
| A. | 简单离子的半径:r(A)<r(C)<r(D)<r(E) | |
| B. | 元素B的最简单气态氧化物的稳定性比C的强 | |
| C. | D2C2与A2C2的漂白原理相同 | |
| D. | 元素E的氧化物能溶于B或D的最高价氧化物对应的水化物中 |
| A. | 25℃时0.1mol/LX2W溶液的pH>1-lg2 | |
| B. | 溶液中水的电离程度:RYX>R2W | |
| C. | 热稳定性:X2Y>X2W | |
| D. | 由X、Y、Z、W、R五种元素组成的一种化合物可作净水剂 |
 .
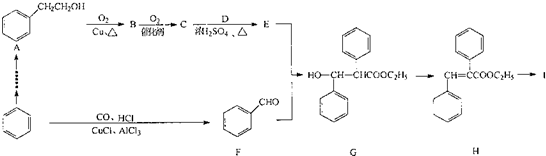
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O:E+F--G的反应类型为加成反应.
+2H2O:E+F--G的反应类型为加成反应. +NaOH$\stackrel{△}{→}$C2H5OH+
+NaOH$\stackrel{△}{→}$C2H5OH+ .
.