题目内容
烃A经催化氢化后转化为最简式是CH2的另一种烃B,5.6克烃B能与12.8克溴完全加成,则烃A可能是下列烃中的( )
| A、CH3CH2CH=CHCH3 |
| B、CH3C≡CH |
| C、CH2=CHCH=CH2 |
| D、CH2=CHC(CH3)=CH2 |
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:烃A经催化氢化后转化为最简式是CH2的另一种烃B,则B为烯烃,烯烃与溴单质按物质的量之比1:1发生加成反应,据此计算B的物质的量,再根据M=
计算B的摩尔质量,确定B的分子式,烃A的不饱和度比B大,且二者含有相同碳原子数目,结合选项确定A的可能结构.
| m |
| n |
解答:
解:烃A经催化氢化后转化为最简式是CH2的另一种烃B,则B为烯烃,5.6克烃B能与12.8克溴完全加成,则溴单质的物质的量=
=0.08mol,而烯烃与溴单质按物质的量之比1:1发生加成反应,则烯烃B的物质的量也是0.08mol,则B的摩尔质量=
=70,令烯烃的组成为(CH2)x,则14x=70,故x=5,则B的分子式为C5H10,烃A的不饱和度比B大,且二者含有相同碳原子数目,选项中只有CH2=CHC(CH3)=CH2符合,故选D.
| 12.8g |
| 160g/mol |
| 5.6g |
| 0.08mol |
点评:本题考查有机物分子式的确定、加成反应,难度不大,理解烯烃的加成反应是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某可逆反应的平衡常数表达式为 K=
,在一密闭容器中发生上述反应,达到平衡后,降低温度,CO2的浓度增大,下列说法中正确的是( )
| c(H2O)?c(CO) |
| c(H2)?c(CO2) |
| A、此反应的△H>0 |
| B、降低温度,逆反应速率增大 |
| C、该反应的化学方程式为CO(g)+H2O(g)?CO2(g)+H2(g) |
| D、恒温、增大压强,CO浓度一定减小 |
甲苯与足量H2加成后的产物,其一氯代物有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
等浓度的下列稀溶液:①乙酸②乙醇钠③乙醇,它们的pH由小到大排列的正确是( )
| A、②③① | B、③①② |
| C、①②③ | D、①③② |
下列说法中正确的是( )
| A、在饱和硫酸铜溶液中放入胆矾晶体,几天后晶体外形发生改变且晶体质量变小 |
| B、检验火柴头中的氯元素,可把燃尽的火柴头浸泡在少量水中,片刻后取少量溶液于试管中,滴加硝酸银溶液和稀硝酸 |
| C、做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 |
| D、在比较乙醇和苯酚与钠反应的实验中,要把乙醇和苯酚配成同物质的量浓度的水溶液,再与相同大小的金属钠反应,来判断两者羟基上氢的活性 |
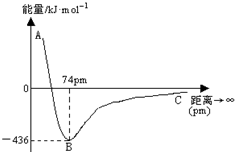 当两个氢原子核间距为74pm时,两个原子轨道发生最大程度的重叠,此时体系的能量最低.如图表示两个气态基态氢原子相互接近形成氢气分子时,体系能量随两个原子的核间距离变化的曲线图,下列关于氢原子形成氢分子说法不正确的有( )
当两个氢原子核间距为74pm时,两个原子轨道发生最大程度的重叠,此时体系的能量最低.如图表示两个气态基态氢原子相互接近形成氢气分子时,体系能量随两个原子的核间距离变化的曲线图,下列关于氢原子形成氢分子说法不正确的有( )| A、氢分子比氢原子稳定 |
| B、氢原子的半径约为37pm |
| C、形成一个H-H键吸收436kJ能量 |
| D、当核间距接近74pm时,形成了氢分子中s~s σ键 |
已知室温时,0.1mol/l某一元酸HA在水中的电离度为0.1%,下列叙述错误的是( )
| A、该溶液的PH=4 |
| B、该温度时,此酸的电离平衡常数约为1×10-7 |
| C、由HA电离出的C(H+)约为水电离出的C(H+)的106倍 |
| D、升高温度,溶液的PH不变 |
已知:C(s,金刚石)=C(s,石墨)△H=-1.9kJ/molC(s,金刚石)+O2(g)=CO2(g)△H1=-a kJ/molC(s,石墨)+O2(g)=CO2(g)△H2=-b kJ/mol根据已述反应所得出的结论正确的是( )
| A、a>b | B、a=b |
| C、a<b | D、金刚石比石墨稳定 |
下列原理或操作不正确的是( )
A、在图装置的稀硫酸中加入适量重铬酸钾或适量6%的H2O2溶液,可以使灯泡亮度增大,持续时间变长 |
| B、在提纯混有少量NaCl的KNO3时,常先将混合物在较高温度下溶于水形成浓溶液,再经过冷却结晶、过滤、洗涤、干燥,获得KNO3晶体 |
| C、制摩尔盐时用酒精洗涤产品,用干净的滤纸吸干;而在制阿司匹林粗品时用冷水洗涤产品,在空气中风干 |
| D、纸层析法分离微量成份时均需有以下流程:装置制作-→点层析试样-→配制展开剂-→层析操作-→显色反应 |