题目内容
15.已知Cu2S可以和硝酸反应,请配平下列化学反应方程式:3Cu2S+16HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+3Cu(NO3)2+10NO↑+8H2O.
分析 Cu2S中Cu、S两种元素的化合价都发生变化,可将其作一整体分析,然后运用化合价升降相等及质量守恒定律配平.
解答 解:在Cu2S中:Cu从+1价升高到+2,化合价升高1价,2个Cu原子升高2价,S元素从-2价升高到+6价,化合价升高了8价,则Cu2S的化合价总共升高了2+8=10价,
而HNO3中N+5→+2化合价降低3,根据化合价的升降守恒:
3Cu2S+□HNO3$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+□Cu(NO3)2+10NO↑+( )
再根据原子守恒得:
S守恒:3Cu2S+□HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+□Cu(NO3)2+10NO↑+( )
Cu守恒:3Cu2S+□HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+3Cu(NO3)2+10NO↑+( )
N守恒:3Cu2S+16HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+3Cu(NO3)2+10NO↑+( )
根据H元素质量守恒得:3Cu2S+16HNO3$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+3Cu(NO3)2+10NO↑+8 H2O,
故答案为:3;16;3;3;10;8H2O.
点评 本题考查了氧化还原反应的配平,题目难度不大,明确氧化还原反应的实质与特征为解答关键,注意掌握根据化合价升降相等配平氧化还原反应的方法,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
5.下列化合物在核磁共振氢谱中能出现两组峰.且其峰面积之比为3:1的有( )
| A. | 乙酸乙酯 | B. | 乙酸异丙酯 | C. | 均三甲苯 | D. | 对二甲苯 |
6.苯在燃烧时不可能生成的是( )
| A. | 二氧化碳 | B. | 水 | C. | 氯化氢 | D. | 一氧化碳 |
20.用惰性电极电解下列物质的水溶液时,在阳极无气体放出的是( )
| A. | AgNO3 | B. | CuCl2 | C. | NaOH | D. | Na2S |
7.砹(At)是原子序数最大的卤族元素,推测砹和砹的化合物最不可能具有的性质是( )
| A. | 砹化氢(HAt)很稳定 | B. | 单质砹易溶于某些有机溶剂 | ||
| C. | 砹的原子半径比碘的原子半径大 | D. | 单质砹是有色固体 |
4.表示阿伏加德罗常数,下列说法正确的是( )
| A. | 0.5molAl与足量盐酸反应转移电子数为1NA | |
| B. | 标准状况下22.4LH2中含中子数为2 NA | |
| C. | 0.5mol CH4所含电子数为5 NA | |
| D. | 1L1 mol/L醋酸溶液中离子总数为2 NA |
5.下列营养素中,不能对人体提供能量的是( )
| A. | 蛋白质 | B. | 糖类 | C. | 维生素 | D. | 油脂 |


 、
、 、
、 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
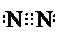 .
.