题目内容
 某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7g上述样品与2.0mol?L-1的NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示.
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7g上述样品与2.0mol?L-1的NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示.请回答下列问题:
(1)A点前样品与NaOH溶液反应的离子方程式为
(2)样品中(NH4)2CO3的质量分数是
(3)当V[NaOH(aq)]=50mL时,生成NH3的体积(标准状况下)为
考点:化学方程式的有关计算
专题:计算题
分析:(1)溶液中碳酸氢根先与氢氧根离子反应生成碳酸根与水,然后铵根离子再与氢氧根离子在加热条件下反应生成氨气与水;
(2)加入70mL NaOH溶液时,溶液中溶质为Na2CO3,根据钠离子守恒计算n(Na2CO3),设NH4HCO3、(NH4)2CO3的物质的量分别为xmol、ymol,根据二者质量之和与碳元素守恒列方程计算,进而计算样品中(NH4)2CO3的质量分数;
(3)当V[NaOH(aq)]=50mL时,依据化学方程式(NH4)2CO3+2NaOH=Na2CO3+2NH3↑+2H2O,NH4HCO3+2NaOH=Na2CO3+NH3↑+2H2O,反应的顺序是先和碳酸氢根离子反应后再和铵根离子反应,结合(2)中的计算得到碳酸氢铵的物质的量,依据氢氧根离子反应定量关系计算生成NH3的体积.
(2)加入70mL NaOH溶液时,溶液中溶质为Na2CO3,根据钠离子守恒计算n(Na2CO3),设NH4HCO3、(NH4)2CO3的物质的量分别为xmol、ymol,根据二者质量之和与碳元素守恒列方程计算,进而计算样品中(NH4)2CO3的质量分数;
(3)当V[NaOH(aq)]=50mL时,依据化学方程式(NH4)2CO3+2NaOH=Na2CO3+2NH3↑+2H2O,NH4HCO3+2NaOH=Na2CO3+NH3↑+2H2O,反应的顺序是先和碳酸氢根离子反应后再和铵根离子反应,结合(2)中的计算得到碳酸氢铵的物质的量,依据氢氧根离子反应定量关系计算生成NH3的体积.
解答:
解:(1)溶液中碳酸氢根先与氢氧根离子反应生成碳酸根与水,然后铵根离子再与氢氧根离子在加热条件下反应生成氨气与水,故A点前样品与NaOH反应的离子方程式为HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
(2)加入70mL NaOH溶液时,溶液中溶质为Na2CO3,根据钠离子守恒n(Na2CO3)=
n(NaOH)=
×0.07L×2mol/L=0.07mol,
设NH4HCO3、(NH4)2CO3的物质的量分别为xmol、ymol,根据二者质量之和与碳元素守恒,则:
解得x=0.06 y=0.01,
样品中(NH4)2CO3的质量分数是
=16.8%,
故答案为:16.8%;
(3)当V[NaOH(aq)]=50mL时,消耗的氢氧化钠物质的量=0.05L×2mol/L=0.1mol,反应过程为:NH4HCO3+2NaOH=Na2CO3+NH3↑+2H2O、(NH4)2CO3+2NaOH=Na2CO3+2NH3↑+2H2O,由(2)知碳酸氢铵物质的量n(NH4HCO3)=
=0.06 mol,则HCO3-消耗OH- 0.06 mol,当V[NaOH(aq)]=50 mL时,与NH4+反应的OH-为2.0 mol/L×0.050 L-0.06 mol=0.04 mol,则生成n(NH3)=0.04 mol,v=nVm=0.04mol×22.4L/mol=0.896L,
故答案为:0.896L.
故答案为:HCO3-+OH-=CO32-+H2O;
(2)加入70mL NaOH溶液时,溶液中溶质为Na2CO3,根据钠离子守恒n(Na2CO3)=
| 1 |
| 2 |
| 1 |
| 2 |
设NH4HCO3、(NH4)2CO3的物质的量分别为xmol、ymol,根据二者质量之和与碳元素守恒,则:
|
样品中(NH4)2CO3的质量分数是
| 0.01mol×96g/mol |
| 5.7g |
故答案为:16.8%;
(3)当V[NaOH(aq)]=50mL时,消耗的氢氧化钠物质的量=0.05L×2mol/L=0.1mol,反应过程为:NH4HCO3+2NaOH=Na2CO3+NH3↑+2H2O、(NH4)2CO3+2NaOH=Na2CO3+2NH3↑+2H2O,由(2)知碳酸氢铵物质的量n(NH4HCO3)=
| 5.7g×(1-16.9%) |
| 79g/mol |
故答案为:0.896L.
点评:本题考查了混合物组成的计算应用,图象理解和数据的利用,氢氧化钠反应过程是先中和后与铵根离子反应的顺序的量计算判断,题目难度中等.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
某有机物6g与足量Na反应,生成0.05mol H2,该有机物可能是( )
| A、CH3CH2OH |
B、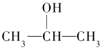 |
| C、CH3OH |
| D、CH3CH2COOH |
常温常压下,某容器真空时质量为116g 当它盛满N2时质量为123 g而盛满某气体Y时质量为120g则Y气体可能是( )
| A、O2 |
| B、CH4 |
| C、C3H8 |
| D、CO |
常温下,向20L真空容器中通入a mol H2S和b mol Cl2 (a、b都是正整数,且a≤5,b≤5),反应完毕后,容器内气体可能达到的最大密度是( )
| A、26.25 g?L-1 |
| B、18.25 g?L-1 |
| C、17.85 g?L-1 |
| D、12.05 g?L-1 |
把0.5molNa和0.5molMg分别投入到过量的m1g水和m2g盐酸中,分别得到溶液ma和mb.若m1=m2,则a与b的质量关系是( )
| A、ma>mb |
| B、ma<mb |
| C、ma=mb |
| D、无法确定 |
下列有关相对原子质量的叙述中,正确的是( )
| A、相对原子质量就是原子的质量 |
| B、氧的相对原子质量是16kg |
| C、相对原子质量是由质子数和电子数决定的 |
| D、相对原子质量与原子质量成正比 |

 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.