题目内容
10.化学与科学技术、社会发展密切相关.下列有关说法中正确的是( )| A. | 古代染坊常用某种“碱剂”来促进丝绸表层的丝胶蛋白杂质水解而除去,该“碱剂”,的主要成分是一种盐.这种“碱剂”可能是草木灰 | |
| B. | 生活中常用的塑料制品、橡胶制品为离分子材料,钢化玻璃、有机玻璃是硅酸盐材料 | |
| C. | 铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单 | |
| D. | 聚乙炔经处理后可形成一种导电塑料,该塑料是一种纯净物,有固定的熔点、沸点 |
分析 A.草木灰主要成分碳酸钾,水解显碱性;
B.钢化玻璃、有机玻璃都是有机物;
C.铝及其合金,具有很多优点:密度低,强度高,接近或超过优质钢,塑性好,可加工成各种型材,具有优良的导电性、导热性和抗蚀性,是电气、工业、家庭广泛使用的材料;
D.高分子化合物都是混合物,混合物不具有固定熔沸点.
解答 解:A.古代染坊常用某种“碱剂”来促进丝绸表层的丝胶蛋白杂质水解而除去,该“碱剂”,的主要成分是一种盐.这种“碱剂”可能是草木灰,故A正确;
B.钢化玻璃、有机玻璃都是有机物,属于有机高分子材料,不是硅酸盐,故B错误;
C.铝及其合金是电气、工业、家庭广泛使用的材料,是因为其良好的性质,故C错误;
D.聚乙炔是一种高分子化合物,是由聚合度不同的乙炔聚合物组成,处理后可形成一种导电塑料,该塑料是一种混合物,没有固定的熔点、沸点,故D错误;
故选:A.
点评 本题考查了元素化合物知识,涉及材料的分类及用途,熟悉盐类水解的性质、常见材料成分及类别是解题关键,题目难度不大.

练习册系列答案
相关题目
20.用中和滴定法测定某烧碱的纯度.
(1)配制待测液 将0.85g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成100mL溶液,所用的主要仪器有烧杯、玻璃棒、100mL容量瓶、量筒、胶头滴管.
(2)滴定 ①盛装0.20mol/L盐酸标准液应该用酸式滴定管.
②滴定时,应先向锥形瓶中加酚酞作为指示剂;滴定过程中两眼应该注视锥形瓶内溶液的颜色变化和滴定速度,滴定终点时,锥形瓶中的溶液的颜色变化是C.(填编号)
A.由黄色变为红色 B.由黄色变为橙色 C.由浅红色变为无色 D.由无色变为红色
③有关数据记录如表:
(3)纯度计算 NaOH溶液的浓度为0.201mol/L,烧碱样品的纯度为94.6%
(4)对几种假定情况的讨论:(填无影响、偏高、偏低)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果无影响
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果偏高.
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果偏低.
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果偏低.
(1)配制待测液 将0.85g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成100mL溶液,所用的主要仪器有烧杯、玻璃棒、100mL容量瓶、量筒、胶头滴管.
(2)滴定 ①盛装0.20mol/L盐酸标准液应该用酸式滴定管.
②滴定时,应先向锥形瓶中加酚酞作为指示剂;滴定过程中两眼应该注视锥形瓶内溶液的颜色变化和滴定速度,滴定终点时,锥形瓶中的溶液的颜色变化是C.(填编号)
A.由黄色变为红色 B.由黄色变为橙色 C.由浅红色变为无色 D.由无色变为红色
③有关数据记录如表:
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
(4)对几种假定情况的讨论:(填无影响、偏高、偏低)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果无影响
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果偏高.
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果偏低.
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果偏低.
1.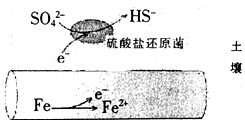 深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )
深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )
 深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )
深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是( )| A. | 正极反应为:SO42-+5H2O+8e-=HS-+9OH- | |
| B. | 输送暖气的管道不易发生此类腐蚀 | |
| C. | 这种情况下,Fe腐蚀的最终产物为Fe2O3•xH2O | |
| D. | 管道上刷富锌油漆可以延缓管道的腐蚀 |
18.下列实验操作能达到相应实验目的是( )
| 选项 | 实验操作 | 实验目的 |
| A | 将C2H4和SO2的混合气体通入足量酸性KmnO4试液中 | 得到纯净的C2H4 |
| B | 向5mL 0.1mol•L-1AgNO3溶液中加1mL0.1mol•L-1NH3•H2O | 制备银氨溶液 |
| C | 向含少量FeBr2的FeCl2溶液中滴入适量新制氯水,并加入CCl4萃取分液 | 制备纯净的FeCl2溶液 |
| D | 向NaCl饱和溶液中先通入NH3至饱和,再通入足量CO2,过滤并洗涤 | 制备NaHCO3固体 |
| A. | A | B. | B | C. | C | D. | D |
5.某同学探究NaHCO3的性质,部分实验报吿记录如下:
下列说法不正确的是( )
| ①常温下,配制0.10moI/L NaHCO3溶液,测其pH为8.4; ②取少量该溶液于试管中,向其中滴加CaCl2溶液至中性,滴加过程中只产生一种白色沉淀(能与盐酸作用产生气体),但无气体放出. |
| A. | NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度 | |
| B. | 加入CaCl2促进了HCO3-的水解 | |
| C. | 反应的离子方程式是2HCO3-+Ca2+═CaCO3↓+H2CO3 | |
| D. | 反应后的溶液中存在:c(Na+)+2c(Ca2+)═c(HCO3-)+2c(CO32-)+c(Cl-)、 |
15.下列有机物的系统命名正确的是( )
| A. | 2-乙基丁烷 | B. | 3,3-二甲基丁烷 | ||
| C. | 2-甲基-1,3-丁二烯 | D. | 2,2-二甲基-3-戊炔 |
19.713N是常用于医学PET显像的一种核素,这里的“7”是指该原子的( )
| A. | 质子数 | B. | 中子数 | C. | 质量数 | D. | 原子个数 |
12.足量的镁与一定量的盐酸反应,减慢反应速度,但又不影响产生H2的量,可以加入的物质是( )
| A. | Al | B. | NaOH | C. | K2CO3 | D. | CH3COONa |