题目内容
在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)??2Fe(s)+3CO2(g).
已知该反应在不同温度下的平衡常数如下表:
请回答下列问题:
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”).
②在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.则该时间范围内反应的平均反应速率v(CO2)= ,CO的平衡转化率为 .
③欲提高②中CO的平衡转化率,可采取的措施是 .
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂.
已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
①该反应的平衡常数表达式K=
②在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.则该时间范围内反应的平均反应速率v(CO2)=
③欲提高②中CO的平衡转化率,可采取的措施是
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂.
考点:化学平衡的计算,化学平衡的影响因素
专题:
分析:①平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积;图表数据分析,随温度升高平衡常数减小;
②依据化学平衡三段式列式计算,令平衡时CO的物质的量变化为nmol,利用三段式表示出平衡时CO、CO2的物质的量,化学计量数都是1,利用物质的量代替浓度代入平衡常数计算n的值,进而计算CO的浓度变化量,反应速率v=
,转化率=
×100%;
③提高CO的平衡转化率,应使平衡向正反应移动,但不能增大CO的用量,结合选项根据平衡移动原理分析.
②依据化学平衡三段式列式计算,令平衡时CO的物质的量变化为nmol,利用三段式表示出平衡时CO、CO2的物质的量,化学计量数都是1,利用物质的量代替浓度代入平衡常数计算n的值,进而计算CO的浓度变化量,反应速率v=
| △c |
| △t |
| 消耗量 |
| 起始量 |
③提高CO的平衡转化率,应使平衡向正反应移动,但不能增大CO的用量,结合选项根据平衡移动原理分析.
解答:
解:(1)①因平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,则K=
,图表数据分析,随温度升高平衡常数减小,正反应是放热反应,△H<0;
故答案为:
;<;
②在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,Q<K=64,反应正向进行,反应经过10min后达到平衡,
令平衡时CO的物质的量变化为nmol,则:
Fe2O3(s)+3CO(g)?Fe(s)+3CO2(g)
开始(mol):1 1
变化(mol):n n
平衡(mol):1-n 1+n
所以
=64,解得n=0.6mol,
所以n(CO)=
=0.006mol?L-1?min-1,
CO的平衡转化率为
×100%=60%,
故答案为:0.006 mol?L-1?min-1;60%;
③A.铁是固体,减少Fe的量,不影响平衡移动,CO的平衡转化率不变,故A错误;
B.氧化铁是固体,增加Fe2O3的量,不影响平衡移动,CO的平衡转化率不变,故B错误;
C.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故C正确;
D.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故D错误;
E.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故E错误;
F.加入合适的催化剂,平衡不移动,故F错误;
故选C.
| c3(CO2) |
| c3(CO) |
故答案为:
| c3(CO2) |
| c3(CO) |
②在一个容积为10L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,Q<K=64,反应正向进行,反应经过10min后达到平衡,
令平衡时CO的物质的量变化为nmol,则:
Fe2O3(s)+3CO(g)?Fe(s)+3CO2(g)
开始(mol):1 1
变化(mol):n n
平衡(mol):1-n 1+n
所以
| (1+n)3 |
| (1-n)3 |
所以n(CO)=
| ||
| 10min |
CO的平衡转化率为
| 0.6mol |
| 1mol |
故答案为:0.006 mol?L-1?min-1;60%;
③A.铁是固体,减少Fe的量,不影响平衡移动,CO的平衡转化率不变,故A错误;
B.氧化铁是固体,增加Fe2O3的量,不影响平衡移动,CO的平衡转化率不变,故B错误;
C.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故C正确;
D.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故D错误;
E.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故E错误;
F.加入合适的催化剂,平衡不移动,故F错误;
故选C.
点评:本题考查化学平衡的有关计算、化学反应速率计算、平衡常数等,化学平衡移动原理分析判断是关键,题目难度中等.

练习册系列答案
相关题目
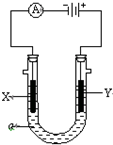
如图所示装置中,a、b都是惰性电极,通电一段时间后,a极附近溶液呈红色.下列说法正确的是( )


| A、NaCl溶液浓度不变 |
| B、X是负极,Y是正极 |
| C、CuSO4溶液浓度变小 |
| D、X是正极,Y是负极 |
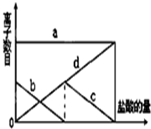 少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )
少量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生如图变化.四条曲线(c和d图象部分重叠)溶液中离子的对应关系,正确的是( )| A、a:Cl-b:K+ c:CO32- d:HCO3- |
| B、a:K+ b:CO32- c:Cl- d:HCO3- |
| C、a:K+ b:CO32- c:HCO3- d:Cl- |
| D、a:K+b:HCO3- c:Cl- d:CO32- |
 (1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度很小的环境中,该原电池的负极是
(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度很小的环境中,该原电池的负极是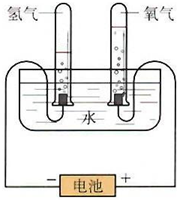 某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究.请按要求填写.
某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究.请按要求填写.