题目内容
5.下列指定微粒的数目相等的是( )| A. | 等物质的量的水与重水含有的中子数 | |
| B. | 等质量的O2和O3含有的原子数 | |
| C. | 同温、同压同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁分别与足量氯气和硫完全反应时转移的电子数 |
分析 A.H和D原子的中子数不同;
B.原子摩尔质量相等,氧气和臭氧质量相等,其原子个数相等;
C.一氧化碳和NO含有的质子数不同;
D.Fe被氯气氧化为+3价,而被S氧化为+2价.
解答 解:A.物质的量相等的H2O与D2O含有的中子数比值为(8):(8+2×1)=8:10,中子数不同,故A错误;
B.O2和O3的组成元素相同,原子摩尔质量相等,氧气和臭氧质量相等,其O原子个数相等,故B正确;
C.CO的质子数为6+8=14,而NO的质子数为7+8=15,同温、同压、同体积的一氧化碳和一氧化碳含有的质子数不相等,故C错误;
D.Fe被氯气氧化为+3价,而被S氧化为+2价,则等物质的量的铁分别与足量氯气和硫完全反应时转移的电子数一定不等,故D错误.
故选B.
点评 本题考查了物质的量的计算和阿伏加德罗常数,题目难度不大,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
16.氮元素是植物生长所需的重要元素.将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵.已知弱电解质在水中的电离平衡常数(25℃)如下表:
现有常温下0.1mol•L-1的(NH4)2CO3溶液,
(1)你认为该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性.
(2)就该溶液中粒子之间有下列关系式,你认为其中正确的是CD.
A.c (NH3•H2O)>c (NH4+)>c (CO32-)>c (HCO3-)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-)+c (HCO3-)+c (H2CO3)=0.1mol•L-1
D.c (NH4+)+c (NH3•H2O)=2c (CO32-)+2c (HCO3-)+2c (H2CO3)
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
(1)你认为该溶液呈碱性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈碱性.
(2)就该溶液中粒子之间有下列关系式,你认为其中正确的是CD.
A.c (NH3•H2O)>c (NH4+)>c (CO32-)>c (HCO3-)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-)+c (HCO3-)+c (H2CO3)=0.1mol•L-1
D.c (NH4+)+c (NH3•H2O)=2c (CO32-)+2c (HCO3-)+2c (H2CO3)
16.铀($\stackrel{235}{92}$U)已经成为新能源的主角.下列有关说法错误的是( )
| A. | 原子序数为92 | B. | 质子数为92 | C. | 电子数为92 | D. | 中子数为92 |
13.关于下列各实验装置的叙述中,不正确的是( )


| A. | 装置①可用于分离酒精和水的混合物 | |
| B. | 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| C. | 装置②中若装满水,收集H2的时候应该从a口通入H2 | |
| D. | 装置①用CCl4萃取碘水中的碘时,CCl4层在下层 |
14.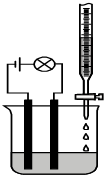 某同学设计了一个测定溶液导电性的实验(如图所示):他先测10.0ml 0.10mol/L H2SO4溶液的导电能力,然后在其中慢慢滴加15.0ml 0.10mol/L Ba(OH)2溶液,并不断搅拌.知溶液中的离子浓度与Ba(OH)2溶液的体积关系如下:
某同学设计了一个测定溶液导电性的实验(如图所示):他先测10.0ml 0.10mol/L H2SO4溶液的导电能力,然后在其中慢慢滴加15.0ml 0.10mol/L Ba(OH)2溶液,并不断搅拌.知溶液中的离子浓度与Ba(OH)2溶液的体积关系如下:
请根据上述题意,回答下列问题:
(1)可观察到的现象为灯泡由亮到暗到灭再到亮,溶液中有白色沉淀产生;当15.0ml 0.10mol/L Ba(OH)2溶液全部滴入H2SO4溶液中后,反应的离子方程式SO42-+2H++Ba2++2OH-═BaSO4↓+2H2O.
(2)有关该实验现象的说法正确的是A
A.溶液的导电性与溶液中自由移动的离子浓度有关
B.灯泡最暗时溶液中自由移动离子的浓度为零
C.往盐酸和硫酸溶液中滴加氢氧化钡溶液时现象相同.
(3)下列物质是该实验中的反应物和生成物,其中属于弱电解质的是D
A.H2SO4 B.Ba(OH)2 C.BaSO4 D.H2O.
 某同学设计了一个测定溶液导电性的实验(如图所示):他先测10.0ml 0.10mol/L H2SO4溶液的导电能力,然后在其中慢慢滴加15.0ml 0.10mol/L Ba(OH)2溶液,并不断搅拌.知溶液中的离子浓度与Ba(OH)2溶液的体积关系如下:
某同学设计了一个测定溶液导电性的实验(如图所示):他先测10.0ml 0.10mol/L H2SO4溶液的导电能力,然后在其中慢慢滴加15.0ml 0.10mol/L Ba(OH)2溶液,并不断搅拌.知溶液中的离子浓度与Ba(OH)2溶液的体积关系如下:| Ba(OH)2(ml) | 溶液中的总离子浓度(mol/L) |
| 0.0 | 0.30 |
| 5.0 | 0.10 |
| 10.0 | ≈0.00 |
| 15.0 | 0.06 |
(1)可观察到的现象为灯泡由亮到暗到灭再到亮,溶液中有白色沉淀产生;当15.0ml 0.10mol/L Ba(OH)2溶液全部滴入H2SO4溶液中后,反应的离子方程式SO42-+2H++Ba2++2OH-═BaSO4↓+2H2O.
(2)有关该实验现象的说法正确的是A
A.溶液的导电性与溶液中自由移动的离子浓度有关
B.灯泡最暗时溶液中自由移动离子的浓度为零
C.往盐酸和硫酸溶液中滴加氢氧化钡溶液时现象相同.
(3)下列物质是该实验中的反应物和生成物,其中属于弱电解质的是D
A.H2SO4 B.Ba(OH)2 C.BaSO4 D.H2O.
15.化学与生产、生活、科技、环境等密切相关,下列说法不正确的是( )
| A. | 食用油反复加热会产生稠环芳香烃等有害物质 | |
| B. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物 |
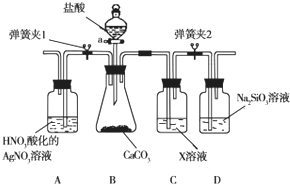 某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).
某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).