题目内容
Wg含有Fe2O3?xH2O杂质的Al2O3样品可完全溶解在100mL c(H+)=0.1mol/L的稀H2SO4中,然后向溶液中加入100mL氨水,恰好得到的沉淀最大质量是N g,则所加氨水的浓度是( )
| A、0.05 mol?L-1 |
| B、0.1 mol?L-1 |
| C、0.15 mol?L-1 |
| D、0.2 mol?L-1 |
考点:有关混合物反应的计算
专题:守恒法
分析:样品与硫酸反应生成硫酸铁、硫酸铝,再向溶液中加入氨水生成沉淀最大时,此时溶液中溶质为(NH4)2SO4,根据硫酸根守恒计算n[(NH4)2SO4],根据N元素守恒计算n(NH3),进而计算氨水的浓度.
解答:
解:稀H2SO4中c(H+)=0.1mol/L,则c(H2SO4)=0.05mol/L,
含有Fe2O3?xH2O杂质的Al2O3样品与硫酸反应生成硫酸铁、硫酸铝,再向溶液中加入氨水生成沉淀最大时,此时溶液中溶质为(NH4)2SO4,
根据硫酸根守恒n[(NH4)2SO4]=n(H2SO4)=0.1L×0.05mol/L=0.005mol,
根据N元素守恒n(NH3)=2n[(NH4)2SO4]=0.01mol,
故氨水的浓度为
=0.1mol/L,
故选B.
含有Fe2O3?xH2O杂质的Al2O3样品与硫酸反应生成硫酸铁、硫酸铝,再向溶液中加入氨水生成沉淀最大时,此时溶液中溶质为(NH4)2SO4,
根据硫酸根守恒n[(NH4)2SO4]=n(H2SO4)=0.1L×0.05mol/L=0.005mol,
根据N元素守恒n(NH3)=2n[(NH4)2SO4]=0.01mol,
故氨水的浓度为
| 0.01mol |
| 0.1L |
故选B.
点评:本题考查混合物计算,难度中等,关键是明确每一步反应利用守恒法解答,侧重考查学生分析问题及解决问题的能力.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量水能使溶液恢复到电解前的浓度的是( )
| A、AgNO3 |
| B、Na2SO4 |
| C、CuCl2 |
| D、HCl |
在100℃时,把0.5mol N2O4通入体积为5L的真空密闭容器中,立即出现红棕色.反应进行到2s时,NO2的浓度为0.02mol/L.在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.下列说法正确的是( )
| A、前2s以N2O4的浓度变化表示的反应速率为0.01mol/(L?s) |
| B、在2s时体系内的压强为开始时的1.1倍 |
| C、在平衡时体系内含N2O4 0.25mol |
| D、平衡时,N2O4的转化率为40% |
分析如下残缺的反应:RO3-+ +6H+=3R2↑+3H2O.下列叙述正确的是( )
| A、上式中缺项所填物质在反应中作氧化剂 | ||
| B、R的原子半径在同周期元素原子中最小 | ||
| C、R一定是周期表中的第VA族元素 | ||
D、RO
|
进行化学实验必须注意安全,下列说法不正确的是( )
| A、不慎将酸液溅到眼中,应立即用大量水冲洗,边洗边眨眼睛 |
| B、不慎将碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 |
| C、洒在桌面上的酒精燃烧,立即用湿抹布盖灭 |
| D、配置硫酸溶液时,可先在量筒中加入一定体积的水,在慢慢倒入浓硫酸,并搅拌 |
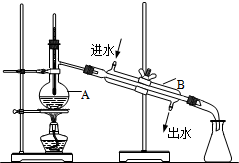 如图为实验室制取自来水的装置示意图,根据图示回答下列问题.
如图为实验室制取自来水的装置示意图,根据图示回答下列问题.