��Ŀ����
����Ŀ��������;�㷺�Ľ���Ԫ�أ����������������ײ����к��ĺ�����ҵ��ˮ��
��1����ԭ�������Ǵ�����Cr2O72����CrO42����ҵ��ˮ��һ�ֳ��÷������乤������Ϊ��CrO42�� ![]() Cr2O72��
Cr2O72�� ![]() Cr3+
Cr3+ ![]() Cr��OH��3��
Cr��OH��3��
���еڢ���ƽ�⣺
2CrO42������ɫ��+2H+Cr2O72������ɫ��+H2O
����ƽ����ϵ��pH=0������Һ��ɫ��
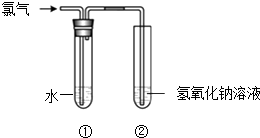
�ڸ���2CrO42��+2H+Cr2O72��+H2O���������ͼװ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7 �� Na2Cr2O7�и�Ԫ�صĻ��ϼ�Ϊ �� ͼ���Ҳ�缫���ӵ�Դ��������缫��ӦʽΪ ��
�۵ڢ�Ӧ�����ӷ���ʽ�� ��
��2��CrO3����ǿ�����ԣ������л����ƾ���ʱ�����ҷ�Ӧ�����Ż����ù������Ҵ������������ᣬCrO3����ԭ����ɫ��Cr2��SO4��3 �� ��ɸ÷�Ӧ�Ļ�ѧ����ʽ��
��CrO3+��C2H5OH+��H2SO4�T��Cr2��SO4��3+��CH3COOH+��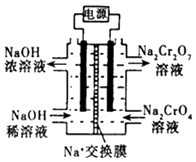
���𰸡�
��1���ȣ�+6������4OH����4e��=O2��+2H2O��6Fe2++Cr2O72��+14H+=6Fe3++2Cr3++7H2O
��2��9H2O
���������⣺��1������ƽ����ϵ��pH=0����Һ���Խ�ǿ��ƽ��2CrO42������ɫ��+2H+�TCr2O72�� ����ɫ��+H2O�����ƶ�����Һ�ʳ�ɫ�����Դ��ǣ��ȣ�
���ɻ��ϼ۴�����Ϊ0��֪Na2Cr2O7�и�Ԫ�صĻ��ϼ�Ϊ+6�ۣ�����2CrO42��+2H+Cr2O72��+H2O���ͼʾװ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7 �� ��Ҫͨ���������H+�����Һ�����ԣ�˵���ڸõ缫�����������ӵ�Դ���������缫��ӦʽΪ4OH����4e��=O2��+2H2O��
���Դ��ǣ�+6��������4OH����4e��=O2��+2H2O��
������������Cr2O72������������ԭ��Ӧ����Ӧ�����ӷ���ʽΪ6Fe2++Cr2O72��+14H+=6Fe3++2Cr3++7H2O��
���Դ��ǣ�6Fe2++Cr2O72��+14H+=6Fe3++2Cr3++7H2O����2��CrO3����ǿ�����ԣ������л����ƾ���ʱ���Ҵ������������ᣬ̼��ƽ�����ϼ۴ө�2�����ߵ�0��1���Ҵ����ϼ۱仯4��CrO3����ԭ����ɫ�������[Cr2��SO4��3]�����Ļ��ϼ۴�+6�۽��͵�+3�ۣ�1��CrO3���ϼ۱仯3�����ߵ���С��������12���ٸ���ԭ���غ��4CrO3+3C2H5OH+6H2SO4=2Cr2��SO4��3+3CH3COOH+9H2O��
���Դ��ǣ�4��3��6��2��3��9H2O��
�����㾫����������Ŀ����֪���������û�ѧƽ��״̬���ʼ����������֪ʶ���Եõ�����Ĵ𰸣���Ҫ���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����ʯī�缫������е��ʵ�飮
ʵ��һ | ʵ��� | |
װ�� |
|
|
���� | a��d����ֽ������b����죬�ֲ���ɫ��c�������Ա仯 | ����ʯī�缫���������ݲ�����n�������ݲ������� |
���ж�ʵ������Ľ��ͻ��Ʋⲻ�������ǣ� ��
A.a��d����2H2O+2e���TH2��+2OH��
B.b����2Cl����2e���TCl2��
C.c�������˷�Ӧ��Fe��2e���TFe2+
D.����ʵ��һ��ԭ����ʵ�����m��������ͭ
����Ŀ�����������Fe��ȥ��ˮ���е������Σ�NO3�����ѳ�Ϊ�������о����ȵ�֮һ��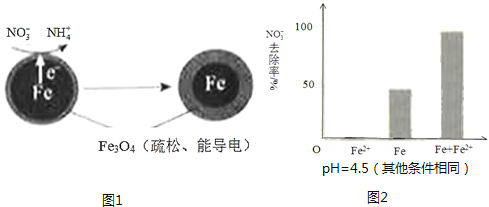
��1��Fe��ԭˮ����NO3���ķ�Ӧԭ����ͼ1��ʾ��
���������������� ��
�������ĵ缫��Ӧʽ�� ��
��2������������Ͷ��ˮ���У���24Сʱ�ⶨNO3����ȥ���ʺ�pH��������£�
��ʼpH | pH=2.5 | pH=4.5 |
NO3����ȥ���� | �ӽ�100% | ��50% |
24СʱpH | �ӽ����� | �ӽ����� |
��������������̬ |
|
|
pH=4.5ʱ��NO3����ȥ���ʵͣ���ԭ���� ��
��3��ʵ�鷢�֣��ڳ�ʼpH=4.5��ˮ����Ͷ���������۵�ͬʱ������һ������Fe2+�����������NO3����ȥ���ʣ���Fe2+������������ּ��裺
��Fe2+ֱ�ӻ�ԭNO3����
��Fe2+�ƻ�FeO��OH�������㣮
�����Ա�ʵ�飬�����ͼ2��ʾ���ɵõ��Ľ����� ��
��ͬλ��ʾ�ٷ�֤ʵFe2+����FeO��OH����Ӧ����Fe3O4 �� ��ϸ÷�Ӧ�����ӷ���ʽ�����ͼ���Fe2+���NO3��ȥ���ʵ�ԭ�� ��
��4�����������루2����ͬ����1Сʱ�ⶨNO3����ȥ���ʺ�pH����������
��ʼpH | pH=2.5 | pH=4.5 |
NO3����ȥ���� | Լ10% | Լ3% |
1СʱpH | �ӽ����� | �ӽ����� |
�루2�������ݶԱȣ����ͣ�2���г�ʼpH��ͬʱ��NO3��ȥ���ʺ���������������̬��ͬ��ԭ�� ��