题目内容
【题目】常温常压条件下,把30mL甲烷和氧气的混合气体点燃,冷却至常温,测得气体的体积为16mL,则原混合气体中甲烷和氧气的体积比?
【答案】解:设参加反应的甲烷和氧气的体积分别x、y.
CH4+ | 2O2 | CO2+ | 2H2O | △V |
1 | 2 | 1 | 2 | |
x | y | 30mL-16mL=14mL |
则 ![]() ,
, ![]() ,解得:x=7mL,y=14mL,
,解得:x=7mL,y=14mL,
由于7mL+14mL=21mL<30mL,剩余气体为:30mL﹣7mL﹣14mL=9mL,
假设剩余的气体为甲烷,则原30mL中甲烷和氧气的体积比为(9mL+7mL):14mL=8:7;
假设剩余的气体为氧气,则原30mL中甲烷和氧气的体积比为7mL:(14mL+9mL)=7:23,
答:原30mL中甲烷和氧气的体积比为8:7或7:23.
【解析】根据题目信息可知,甲烷和氧气生成二氧化碳和水,常温下水为液态,最后气体的体积16mL,气体的体积减少了,根据化学方程式找出变化量与各个量之间的关系,代入数据进行计算.

 备战中考寒假系列答案
备战中考寒假系列答案【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
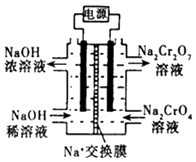
实验室用干燥、纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
(1)仪器A冷却水的进水口为(填“a”或“b”)。
(2)仪器B中盛放的药品是。
(3)实验时,装置丁中发生反应的离子方程式为。
(4)装置丙的作用为 , 若缺少装置乙,则硫酰氯会水解,该反应的化学
方程式为。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+ SO2Cl2 , 此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):。