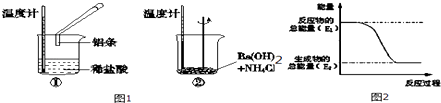
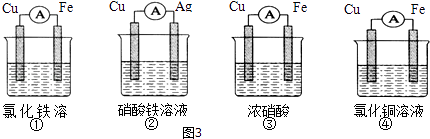
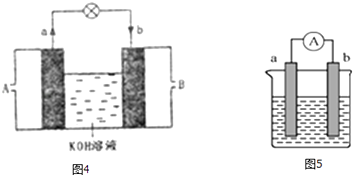
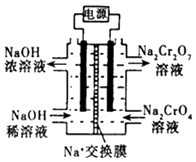
题目内容
【题目】前四周期A,B,C,D,E,F,G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属 请回答下列问题:(用推出的元素符号或者化学式作答)
(1)F的价电子排布式为 , B,C,D三种元素的第一电离能从大到小的顺序为 .
(2)BD32﹣中B原子的杂化方式为 , 该离子的空间构型为
(3)写出一种由A,C,D组成且既含离子键又含共价键的物质的化学式 , 化合物ABC中σ键和π键数目之比为 , C的气态氢化物在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因 .
(4)E和G形成的某种晶胞如下图所示:其中白球表示E,黑球表示G.则该物质的化学式为 , 假设该晶胞的密度为ρ g/cm3 , 用NA表示阿伏加德罗常数,则该晶胞中距离最近的G原子之间的距离为cm. 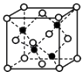
【答案】
(1)3d54s1;N>O>C
(2)sp2杂化;平面正三角形
(3)NH4NO3或者NH4NO2;1:1;NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大
(4)FeS;![]() ×
× ![]()
【解析】解:根据“A元素的质子数和质量数相等”推知A为H(氢);根据“B元素具有三个能级且所排电子数相同”推知B为C(碳);根据“D元素2p能级上电子数是2s能级的两倍”推知D为O(氧);根据“B、C、D原子序数依次增大”推知C为N(氮);根据“D和E相邻且同主族”推知E为S(硫);第四周期中Cr元素的未成对电子高达6个最多,故F为Cr(铬);根据“G是目前使用量最多的金属”推知G为Fe(铁).(1)Cr的价电子排布式是保证3d能级和4s能级都处于半充满状态,更加稳定,故Cr的价电子排布为3d54s1;第一电离能同一周期从左到右呈增大趋势,ⅡA族、Ⅴ族反常,故的原动力N>O>C;所以答案是:3d54s1;N>O>C;(2)CO32﹣中C原子孤电子对数= ![]() =0,价层电子对数=3+0=3,故碳原子杂化方式为sp2杂化,空间构型为平面正三角形,所以答案是:sp2杂化;平面正三角形;(3)铵盐属于离子化合物存在离子键也存在共价键,三种元素形成的铵盐可以是NH4NO3或者NH4NO2;HCN中存在两条σ键和2条π键,二者之比为1:1;NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大,所以答案是:NH4NO3或者NH4NO2;1:1;NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大;(4)黑球铁处于晶胞晶胞,晶胞中含有4个Fe原子,白球S处于顶点和面心,晶胞中含有S原子数目为6×
=0,价层电子对数=3+0=3,故碳原子杂化方式为sp2杂化,空间构型为平面正三角形,所以答案是:sp2杂化;平面正三角形;(3)铵盐属于离子化合物存在离子键也存在共价键,三种元素形成的铵盐可以是NH4NO3或者NH4NO2;HCN中存在两条σ键和2条π键,二者之比为1:1;NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大,所以答案是:NH4NO3或者NH4NO2;1:1;NH3通过氢键形成“缔合”分子,导致相对分子质量增大,分子间作用力增强,分子间距离减小,导致密度反常增大;(4)黑球铁处于晶胞晶胞,晶胞中含有4个Fe原子,白球S处于顶点和面心,晶胞中含有S原子数目为6× ![]() +8×
+8× ![]() =4,约成最简整数比既得化学式为FeS,晶胞质量为4×
=4,约成最简整数比既得化学式为FeS,晶胞质量为4× ![]() g,假设该晶胞的边长为a cm,则(a cm)3×ρ g/cm3=4×
g,假设该晶胞的边长为a cm,则(a cm)3×ρ g/cm3=4× ![]() g,则a=
g,则a= ![]() ,距离最近的S原子之间距离为晶胞边长的
,距离最近的S原子之间距离为晶胞边长的 ![]() ,故S原子之间距离为
,故S原子之间距离为 ![]() ×
× ![]() cm,所以答案是:FeS;
cm,所以答案是:FeS; ![]() ×
× ![]() .
.