题目内容
20.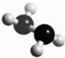 肼(N2H4)是火箭燃料,常温下为液体,其分子的球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.下列说法正确的是( )
肼(N2H4)是火箭燃料,常温下为液体,其分子的球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.下列说法正确的是( )| A. | 11.2L N2中含电子总数为7×6.02×1023 | |
| B. | 3.2g N2H4中含有共价键的总数为6×6.02×1022 | |
| C. | 标准状况下,22.4L H2O2中所含原子总数为4×6.02×1023 | |
| D. | 若生成3.6g H2O,则上述反应转移电子的数目为2×6.02×1022 |
分析 A、氮气所处的状态不明确;
B、求出肼的物质的量,然后根据1mol肼中含5mol共价键来分析;
C、标况下双氧水为液态;
D、在反应中,氧元素的价态由-1价变为-2价.
解答 解:A、氮气所处的状态不明确,故不能计算出其物质的量和含有的电子总数,故A错误;
B、3.2g肼的物质的量为n=$\frac{3.2g}{32g/mol}$=0.1mol,而1mol肼中含5mol共价键,故0.1mol肼中含0.5mol共价键即0.5NA个,故B错误;
C、标况下双氧水为液态,故不能根据气体摩尔体积来计算其物质的量和具有的原子总数,故C错误;
D、在反应中,氧元素的价态由-1价变为-2价,故当生成3.6g水即0.2mol水时,转移0.2mol电子即0.2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
10.下列叙述错误的是( )
| A. | 将溴水加入苯中,溴水的颜色变浅,是溴与苯发生了加成反应 | |
| B. | 苯分子中的碳原子之间的键完全相同,是一种介于单键和双键之间的独特的键 | |
| C. | 1 mol乙烷和丙烯的混合物,完全燃烧生成3 mol H2O | |
| D. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
8.下列物质不是常见的氧化剂的是( )
| A. | O2 | B. | HNO3 | C. | KMnO4 | D. | CO |
5.下列化学用语表达正确的是( )
| A. | HF的电子式为: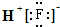 | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| D. | Cl-的结构示意图: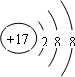 |
12.下列有关说法不正确的是( )
| A. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| B. | 铅蓄电池中Pb作负极,PbO2作正极 | |
| C. | 在物质的量浓度相等的NaCl和KBr的混合溶液中滴加AgNO3溶液,先产生淡黄色沉淀 | |
| D. | 常温下,pH=3的盐酸、醋酸分别用水稀释m倍、n倍后pH相同,则m<n |
 .
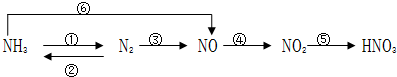
.
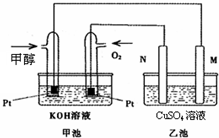 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出以甲醇为燃料的燃料电池.已知图甲池为甲醇燃
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇和水,并开发出以甲醇为燃料的燃料电池.已知图甲池为甲醇燃