题目内容
8. 化合物AX3和单质X2在一定条件下反应可生成化合物AX5,该反应不能彻底.回答下列问题:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5,该反应不能彻底.回答下列问题:(1)已知AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成lmol AX5时,放出热量123.8kJ.该反应的热化学方程式为AX3(l)+X2(g)=AX5(s)△H=-123.8kJ•mol-1.
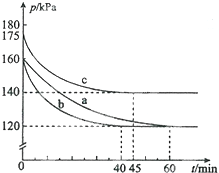
(2)一定条件下,反应AX3(g)+X2(g)?AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行a、b、c三组实验,反应体系总压强随时间的变化如图所示.
①用P0表示开始时总压强,P表示平衡时总压强,用α表示AX3的平衡转化率,则α的表达式为α=2(1-$\frac{p}{{p}_{0}}$).由此计算实验c中 AX3的平衡转化率:αc为40%.若在实验a中再加入0.1mol AX5,再次达平衡后AX3的平衡转化率将增大.(填“增大、减小或不变”)
②下列不能说明反应达到平衡状态的是B.
A.混合气体的平均相对分子质量保持不变
B.混合气体密度保持不变
C.体系中X2的体积分数保持不变
D.每消耗1mol AX3的同时消耗1mol AX5
③计算实验a从反应开始至到达平衡v(AX5)化学反应速率为0.00017mol/(L•min).(保留2位有效数字)
④图中3组实验从反应开始至到达平衡时的化学反应速率v(AX5)由大到小的次序为b>c>a(填实验序号);与实验a相比,其他两组改变的实验条件是:b加入催化剂、c升高温度.该反应在实验a和实验c中的化学平衡常数的大小关系是Ka>Kc(填“>、<或=”),其中Kc=55.6L/mol(保留小数点后1位).
分析 (1)根据熔沸点判断出常温下各物质聚集状态,注明聚集状态与反应热书写热化学方程式;
(2)①用α表示AX3的平衡转化率,则参加反应AX3为0.2α mol,则:
AX3(g)+X2(g)?AX5(g)
起始(mol):0.2 0.2 0
转化(mol):0.2α 0.2α 0.2α
平衡(mol):0.2(1-α) 0.2(1-α) 0.2α
相同温度体积下,压强之比等于其物质的量之比,据此列方程计算α的表达式;
由图可知,实验c中$\frac{p}{{p}_{0}}$=$\frac{140}{175}$,代入α的表达式计算;
若在实验a中再加入0.1mol AX5,等效为增大压强,等效后平衡向正反应方向移动,再次达平衡后AX3的平衡转化率将增大;
②可逆反应到达平衡时,正逆反应速率相等,各组分的含量、浓度保持不变,由此衍生其它一些物理量不变,注意选择判断平衡的物理量应随反应进行发生变化,当该物理量由变化到不变化,说明到达平衡;
③由图可知,实验a在60min时到达平衡,平衡时AX3的α=2(1-$\frac{p}{{p}_{0}}$)=2×(1-$\frac{120}{160}$)=50%,则参加反应AX3的物质的量为0.2mol×50%=0.1mol,根据方程式可知生成AX5的物质的量,再根据v=$\frac{△c}{△t}$计算v(AX5;
④由于恒温恒容下,压强之比等于气体物质的量之比,故相同时间内压强变化量越大,反应速率越快;
实验a、b相比,起始压强相等,平衡时压强不变,改变条件不影响平衡移动,但b到达平衡的时间较短,反应速率较快,由于反应前后气体的体积减小,b应是使用催化剂;
a、c相比c组的反应速率加快,平衡时c的压强变化相对较小,说明与a相比,平衡逆向移动,说明是温度升高;
正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,而c组的温度高于a组;
c组平衡时,AX3的平衡转化率αc为40%,平衡常数K=$\frac{c(A{X}_{5})}{c(A{X}_{3})×c({X}_{2})}$=$\frac{n(A{X}_{5})}{n(A{X}_{3})×n({X}_{2})}$×V=($\frac{0.2α}{0.2(1-α)×0.2(1-α)}$×10)L/mol,代入数据计算.
解答 解:(1)因为AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃,则室温时,AX3为液态,AX5为固态,生成1mol AX5,放出热量123.8kJ,该反应的热化学方程为:AX3(l)+X2(g)=AX5(s)△H=-123.8kJ•mol-1,
故答案为:AX3(l)+X2(g)=AX5(s)△H=-123.8kJ•mol-1;
(2)用α表示AX3的平衡转化率,则参加反应AX3为0.2α mol,则:
AX3(g)+X2(g)?AX5(g)
起始(mol):0.2 0.2 0
转化(mol):0.2α 0.2α 0.2α
平衡(mol):0.2(1-α) 0.2(1-α) 0.2α
相同温度体积下,压强之比等于其物质的量之比,故0.4:[0.2(1-α)+0.2(1-α)+0.2α]=P0:P,整理得:α=2(1-$\frac{p}{{p}_{0}}$),
由图可知,实验c中$\frac{p}{{p}_{0}}$=$\frac{140}{175}$,则 AX3的平衡转化率αc为2×(1-$\frac{140}{175}$)=40%,
若在实验a中再加入0.1mol AX5,等效为增大压强,等效后平衡向正反应方向移动,再次达平衡后AX3的平衡转化率将增大,
故答案为:α=2(1-$\frac{p}{{p}_{0}}$);40%;增大;
②A.混合气体总质量不变,随反应进行总物质的量增大,平均相对分子质量减小,混合气体的平均相对分子质量保持不变,说明反应到达平衡,故A正确;
B.混合气体总质量不变,容器体积不变,混合气体密度始终保持不变,不能说明到达平衡,故B错误;
C.X2的体积分数保持不变,说明到达平衡,故C正确;
D.每消耗1mol AX3的同时消耗1mol AX5,则消耗1mol AX5的同时生成1molAX3,AX3的生成速率与消耗速率相等,反应到达平衡,故D正确,
故选:B;
③由图可知,实验a在60min时到达平衡,平衡时AX3的α=2(1-$\frac{p}{{p}_{0}}$)=2×(1-$\frac{120}{160}$)=50%,则参加反应AX3的物质的量为0.2mol×50%=0.1mol,由方程式可知生成AX5的物质的量为0.1mol,故v(AX5)=$\frac{\frac{0.1mol}{10L}}{60min}$=0.00017mol/(L•min ),
故答案为:0.00017;
④由于恒温恒容下,压强之比等于气体物质的量之比,故相同时间内压强变化量越大,反应速率越快,由图可知,从开始到平衡时a、b、c压强分别为40kPa、40kPa、35kPa,所用时间分别为60min、40min、45min,每分钟内压强平均变化分别为$\frac{40}{60}$Pa、$\frac{40}{40}$Pa、$\frac{35}{45}$Pa,故反应速率b>c>a;
实验a、b相比,起始压强相等,平衡时压强不变,改变条件不影响平衡移动,但b到达平衡的时间较短,反应速率较快,由于反应气体气体的体积减小,b应是使用催化剂;
a、c相比c组的反应速率加快,平衡时c的压强变化相对较小,说明与a相比,平衡逆向移动,说明是温度升高;
正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,而c组的温度高于a组,故平衡常数Ka>Kc;
c组平衡时,AX3的平衡转化率αc为40%,平衡常数K=$\frac{c(A{X}_{5})}{c(A{X}_{3})×c({X}_{2})}$=$\frac{n(A{X}_{5})}{n(A{X}_{3})×n({X}_{2})}$×V=($\frac{0.2α}{0.2(1-α)×0.2(1-α)}$×10)L/mol=($\frac{0.2×0.4}{0.2(1-0.4)×0.2×(1-0.4)}$×10)L/mol=55.6L/mol,
故答案为:b>c>a;加入催化剂;升高温度;>;55.6L/mol.
点评 本题考查化学平衡计算,过程复杂且为字母型计算,属于易错题目,是对学生综合能力的考查,需要学生具备扎实的基础,题目难度较大.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案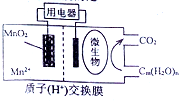 如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )| A. | 分子组成为Cm(H2O)n的物质一定是糖类 | |
| B. | 正极反应式为:MnO2+4H++2e-=Mn2++2H2O | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若Cm(H2O)n是葡萄糖,当电路中转移了6NA电子时,反应的葡萄糖质量是60g. |
工业上可用如下方法合成甲醇:
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
③H2O(l)═H2O(g)△H=+44.0kJ•mol-1
则甲醇不完全燃烧生成CO和液态水的热化学反应方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(2)方法一生产甲醇是目前工业上常用的方法.在一定温度下,向2L密闭容器中充入1molCO和2molH2,发生上述反应,5分钟反应达平衡,此时CO的转化率为80%.请回答下列问题:
①前5分钟内甲醇的平均反应速率为0.08mol/(L•min);已知该反应在低温下能自发进行,则反应的△H为<(填“>”、“<”或“=”)0.
②在该温度下反应的平衡常数K=100.
③在图甲方框的坐标系中画出甲醇的物质的量浓度随时间的变化曲线.

(画在答题纸上)
④关于上述反应,下列叙述不正确的是A(填编号).
A.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(CO)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和压强不变,再向容器中充入0.8molCO和0.6mol CH3OH,则此时v正>v逆
(3)方法二生产甲醇应更具前景,写出方法二生产甲醇的一个优点减少二氧化碳的排放,有效控制温室效应.
(4)根据反应2CH3OH(g)?CH3OCH3(g)+H2O(g),可利用CH3OH生产CH3OCH3.
有人对甲醇脱水转化为二甲醚过程从温度、液体空速(在单位时间内单位体积的催化剂表面通过的原料的量,空速越小,停留时间越长,反应程度越高,但处理能力越小)、压力对甲醇的转化率影响进行研究,分别获得图乙2幅图.
根据以上两幅图选择不受空速影响的合适反应温度和压强320℃、0.2-0.6Mpa.
(5)根据文献,甲醇生产二甲醚的转化率可以根据冷凝的液相中的甲醇与水的相对百分含量来计算(忽略挥发到气相的甲醇).若以Cw表示冷凝液中水的质量分数,CM表示冷凝液中甲醇的质量分数,则甲醇的转化率xM=$\frac{32C{\;}_{W}}{32C{\;}_{W}+9C{\;}_{M}}$.
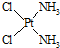 )中的Pt的化合价为+2.
)中的Pt的化合价为+2.
 .
. +
+ $\stackrel{H+}{?}$
$\stackrel{H+}{?}$ +(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种.
+(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种. 合成
合成 的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图:
的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图: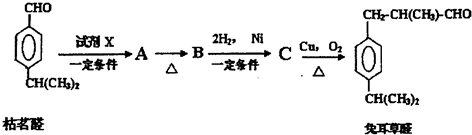
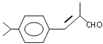 ;检验B中的官能团时,需先加入的试剂是新制氢氧化铜悬浊液;酸化后,再加入的试剂是溴水或高锰酸钾溶液.
;检验B中的官能团时,需先加入的试剂是新制氢氧化铜悬浊液;酸化后,再加入的试剂是溴水或高锰酸钾溶液. .
.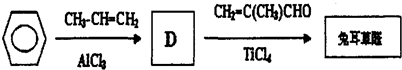
 .D→兔耳草醛的反应类型是加成反应.
.D→兔耳草醛的反应类型是加成反应. 、
、 .
.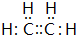 ,A的结构简式H2C=CH2.
,A的结构简式H2C=CH2. ,写出B的一种含三键且无支链的链烃的结构简式CH≡C-CH=CH-CH=CH2.
,写出B的一种含三键且无支链的链烃的结构简式CH≡C-CH=CH-CH=CH2.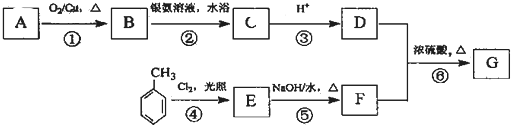
 ;
; .
.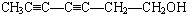 或
或 或
或 .
.