题目内容
3.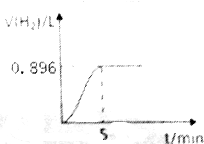 取1.27g钠铝合金放入50mL水中,充分反应后有固体剩余,其产生气体的体积随时间的变化曲线如图所示(气体体积已折算成标准状况),按要求回答下列问题:
取1.27g钠铝合金放入50mL水中,充分反应后有固体剩余,其产生气体的体积随时间的变化曲线如图所示(气体体积已折算成标准状况),按要求回答下列问题:(1)用单位时间内H2物质的量变化表示的甲均反应速率为0.008mol•min-1.
(2)合金中铝的质量为0.81g.
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算出生成氢气的物质的量,然后根据v=$\frac{△n}{△t}$计算出用氢气表示的平均反应速率;
(2)反应后固体有剩余,由于钠与水反应,则剩余的固体为Al,反应后溶质为偏铝酸钠,设出偏铝酸钠的物质的量,然后根据电子守恒计算出Na、Al的物质的量,然后得出钠的质量,从而可知合金中铝的质量.
解答 解:(1)标准状况下0.896L氢气的物质的量为:$\frac{0.896L}{22.4L/mol}$=0.04mol,则用用单位时间内H2物质的量变化表示的平均反应速率为:$\frac{0.04mol}{5min}$=0.008mol•min-1,
故答案为:0.008mol•min-1;
(2)取1.27g钠铝合金放入50mL水中,充分反应后有固体剩余,剩余的固体为Al,反应后生成溶质为NaAlO2,设生成偏铝酸钠的物质的量为x,
根据电子守恒可知:x+3x=0.04×2,解得:x=0.02mol,
根据质量守恒可知原合金中Na的物质的量为0.02mol,质量为:23g/mol×0.02mol=0.46g,
则原合金中铝的质量为:1.27g-0.46g=0.81g,
故答案为:0.81.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握电子守恒、质量守恒在化学计算中的应用方法,试题培养了学生的分析能力就化学计算能力.

练习册系列答案
相关题目
11.足量铁粉与一定量的盐酸反应,能产生一定量的氢气.为减慢反应速率,但不影响H2的总量,可以加入下列物质中的( )
| A. | CuSO4 | B. | NaOH | C. | Na2CO3 | D. | CH3COONa |
18.生产、生活中离不开各类化学物质.下列化学物质中属于盐类的是( )
| A. | 苏打 | B. | 铁红 | C. | 水晶 | D. | 生石灰 |
4.粗盐中含有可溶性杂质CaCl2、MgCl2和Na2SO4,若要得到纯净的NaCl固体,有如下实验操作:
①蒸发结晶
②加入过量NaOH溶液
③加入过量BaCl2溶液
④加入过量Na2CO3溶液
⑤加入过量盐酸
⑥过滤.
正确的实验操作顺序是( )
①蒸发结晶
②加入过量NaOH溶液
③加入过量BaCl2溶液
④加入过量Na2CO3溶液
⑤加入过量盐酸
⑥过滤.
正确的实验操作顺序是( )
| A. | ②③④⑤⑥① | B. | ③④②⑤① | C. | ③②④⑥⑤① | D. | ④③⑥⑤① |
1.下列说法正确的是( )
| A. | 碱金属单质的熔点随原子序数的增大而降低 | |
| B. | 金属元素的最外层电子数都小于4 | |
| C. | 已知硒(Se)位于第四周期第ⅥA族,其最高价氧化物对应水化物的化学式为H2SeO3 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
2.下列说法正确的是( )
| A. | 氯水和二氧化硫都具有漂白作用,两者漂白原理相同 | |
| B. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等,途径a:Cu$→_{△}^{O_{2}}$CuO$?_{加热}^{稀H_{2}SO_{4}}$CuSO4;途径b:Cu$→_{△}^{浓硫酸}$CuSO4 | |
| C. | 不用其它化学试剂只用适当仪器就可以区别NaCO3溶液和稀硫酸 | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |