题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
①pH=0的溶液:Na+、C2O42-、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度c(H+)=10-12mol?L-1的溶液中:Cl-、CO32-、NO3-、NH4+、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使石蕊变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、I-、Cl-、S2-.
①pH=0的溶液:Na+、C2O42-、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度c(H+)=10-12mol?L-1的溶液中:Cl-、CO32-、NO3-、NH4+、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使石蕊变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、I-、Cl-、S2-.
| A、①③⑤ | B、③②⑥ |
| C、②④ | D、①④⑤ |
考点:离子共存问题
专题:
分析:①pH=0的溶液为酸性溶液,高锰酸根离子在酸性条件下具有强氧化性,能够氧化醋酸根离子;
②pH=11的溶液中存在大量氢氧根离子,:CO32-、Na+、AlO2-、NO3-、S2-、SO32-离子之间不满足离子反应发生条件,且都不与氢氧根离子反应;
③水电离的H+浓度c(H+)=10-12mol?L-1的溶液为酸性或者碱性溶液,碳酸根离子、亚硫酸根离子能够与氢离子反应,铵根离子能够与氢氧根离子反应;
④加入Mg能放出H2的溶液中存在大量氢离子,Mg2+、NH4+、Cl-、K+、SO42-离子之间不发生反应,都不与氢离子反应;
⑤使石蕊变红的溶液为酸性溶液,溶液中存在大量氢离子,硝酸根离子、高锰酸根离子能够氧化亚铁离子;
⑥铁离子能够氧化碘离子、硫离子,铝离子能够与硫离子发生双水解反应.
②pH=11的溶液中存在大量氢氧根离子,:CO32-、Na+、AlO2-、NO3-、S2-、SO32-离子之间不满足离子反应发生条件,且都不与氢氧根离子反应;
③水电离的H+浓度c(H+)=10-12mol?L-1的溶液为酸性或者碱性溶液,碳酸根离子、亚硫酸根离子能够与氢离子反应,铵根离子能够与氢氧根离子反应;
④加入Mg能放出H2的溶液中存在大量氢离子,Mg2+、NH4+、Cl-、K+、SO42-离子之间不发生反应,都不与氢离子反应;
⑤使石蕊变红的溶液为酸性溶液,溶液中存在大量氢离子,硝酸根离子、高锰酸根离子能够氧化亚铁离子;
⑥铁离子能够氧化碘离子、硫离子,铝离子能够与硫离子发生双水解反应.
解答:
解:①pH=0的溶液中氢离子浓度为1mol/L,MnO4-在酸性条件下能够氧化C2O42-,在溶液中不能大量共存,故①错误;
②pH=11的溶液中氢氧根离子浓度为0.001mol/L,CO32-、Na+、AlO2-、NO3-、S2-、SO32-离子之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故②正确;
③水电离的H+浓度c(H+)=10-12mol?L-1的溶液中存在大量氢离子或氢氧根离子,CO32-、SO32-与氢离子反应,NH4+与氢氧根离子反应,在溶液中不能大量共存,故③错误;
④加入Mg能放出H2的溶液中存在大量氢离子,Mg2+、NH4+、Cl-、K+、SO42-离子之间不反应,且都不与氢离子反应,在溶液中能够大量共存,故④正确;
⑤使石蕊变红的溶液中存在大量氢离子,MnO4-、NO3-在酸性条件下具有强氧化性,能够氧化Fe2+,在溶液中不能大量共存,故⑤错误;
⑥Fe3+能够氧化I-、S2-,Al3+在溶液中与S2-发生双水解反应,在溶液中不能大量共存,故⑥错误;
根据以上分析,在溶液中能够大量共存的为②④
故选C.
②pH=11的溶液中氢氧根离子浓度为0.001mol/L,CO32-、Na+、AlO2-、NO3-、S2-、SO32-离子之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故②正确;
③水电离的H+浓度c(H+)=10-12mol?L-1的溶液中存在大量氢离子或氢氧根离子,CO32-、SO32-与氢离子反应,NH4+与氢氧根离子反应,在溶液中不能大量共存,故③错误;
④加入Mg能放出H2的溶液中存在大量氢离子,Mg2+、NH4+、Cl-、K+、SO42-离子之间不反应,且都不与氢离子反应,在溶液中能够大量共存,故④正确;
⑤使石蕊变红的溶液中存在大量氢离子,MnO4-、NO3-在酸性条件下具有强氧化性,能够氧化Fe2+,在溶液中不能大量共存,故⑤错误;
⑥Fe3+能够氧化I-、S2-,Al3+在溶液中与S2-发生双水解反应,在溶液中不能大量共存,故⑥错误;
根据以上分析,在溶液中能够大量共存的为②④
故选C.
点评:本题考查离子共存的判断,为高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时,pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时,pH变化曲线如图所示,下列判断正确的是( )| A、a、c两点溶液的导电能力相同 |
| B、a、b、c三点溶液中水的电离程度:a>b=c |
| C、用等浓度的NaOH溶液分别与等体积的b、c两点溶液恰好完全反应,消耗NaOH溶液的体积相等 |
| D、b点溶液中存在微粒浓度关系:c(H+)=c(OH-)+c(NH3?H2O) |
如图中装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体.该装置可用于( ) 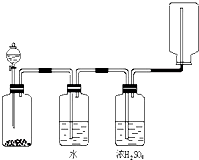

| A、锌和盐酸生成氢气 |
| B、亚硫酸钠和浓硫酸生成二氧化硫 |
| C、碳酸钙和盐酸生成二氧化碳 |
| D、氯化钠和浓硫酸生成氯化氢 |
某密闭容器中,发生反应2A(g)?B(g)△H<0,达到平衡后,
=a,若改变条件,反应再次达到平衡时
=b,下列说法正确的是( )
| c(A) |
| c(B) |
| c(A) |
| c(B) |
| A、若其他条件不变,升高温度,则a>b |
| B、保持温度、压强不变,充入惰性气体,则有a=b |
| C、在该温度下,保持容积固定不变,向容器内补充A气体,则a>b |
| D、若a=b,则容器中的反应一定是使用了催化剂 |
 红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如下图所示,图中的△H表示生成1mol产物的数据.已知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应.下列说法正确的是( )
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如下图所示,图中的△H表示生成1mol产物的数据.已知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应.下列说法正确的是( )| A、其他条件不变,升高温度有利于PCl5的生成 |
| B、反应2P(s)+5Cl2(g)=2PCl5(g)对应的反应热△H=-798KJ?mol-1 |
| C、P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)=2PCl3(g)△H=-306KJ?mol-1 |
| D、PCl5分解为PCl3和Cl2的热化学方程式为PCl5(g)=PCl3(g)+Cl2(g)△H=-93KJ?mol-1 |
 W、X、Y、Z为四种短周期主族元素,其位置关系如图.
W、X、Y、Z为四种短周期主族元素,其位置关系如图.