题目内容
5.A、B是元素周期表中同周期的两种主族元素,它们可以形成离子化合物AmBn,且离子均达到稀有气体原子的电子层结构.若A的原子序数为a,则B的原子序数可能是( )| A. | 8-m-n | B. | a-8+m-n | C. | a+18-m-n | D. | a+24-m-n |
分析 同周期的两种主族元素A和B能够形成离子化合物AmBn,则A为金属元素,B为非金属元素,已知A的原子序数为a,则离子中A少了一个电子层,B的电子层不变,以此来解答.
解答 解:同周期的两种主族元素A和B能够形成离子化合物AmBn,则A为金属元素,B为非金属元素,已知A的原子序数为a,则离子中A少了一个电子层,B的电子层不变,
若在短周期,A的原子序数为a,则B的原子序数为(a-m)+8-n=a+8-m-n,
若在四、五周期,A的原子序数为a,则B的原子序数为(a-m)+18-n=a+18-m-n,
若在六、七周期,A的原子序数为a,则B的原子序数为(a-m)+32-n=a+32-m-n,
故选C.
点评 本题考查周期表的结构及应用,把握同周期形成离子化合物中最外层电子数相差8或18等为解答的关键,侧重分析与应用能力的考查,注意周期表结构的应用,题目难度不大.

练习册系列答案
相关题目
15.最简式相同,但既不是同系物,又不是同分异构体的是( )
| A. | 辛烯和3-甲基-1-丁烯 | B. | 苯和乙炔 | ||
| C. | 1-氯丙烷和2-氯丙烷 | D. | 软脂酸和硬脂酸 |
16.向20mL 2mol/L AlCl3溶液中加入30mL NaOH溶液,充分反应后得到0.78g沉淀,由此可知NaOH溶液的物质的量浓度应该是( )
①1mol/L ②2mol/L ③5mol/L ④8mol/L.
①1mol/L ②2mol/L ③5mol/L ④8mol/L.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
13.在120℃的条件下,将体积比为1:1总质量为7.2g的CO与H2的混合气体在足量的O2中充分燃烧,然后将产生的气体通过足量的Na2O2固体中充分反应,反应后固体增加的质量为( )
| A. | 4.5 g | B. | 7.2 g | C. | 9.3 g | D. | 无法计算 |
20.下列说法正确的是( )
| A. | 铅蓄电池在放电过程中,负极质量增加,正极质量也增加 | |
| B. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 |
4.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,2.24 L CCl4含有0.1 NA个CCl4分子 | |
| B. | 18gD2O含有的质子数为10NA | |
| C. | 标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| D. | 1.5molCu和足量稀硝酸反应产生NA个NO分子 |
1.对下列实验过程的评价,正确的是( )
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| B. | 验证溶液中是否含有Cl-,加稀硝酸酸化的AgNO3溶液,有白色沉淀,证明含Cl- | |
| C. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| D. | 某溶液中滴加盐酸酸化的BaCl2溶液,生成白色沉淀,证明一定含有SO42- |
2.下列各组中的两种物质互为同分异构体的是( )
| A. | 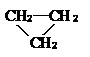 和CH3CH=CH2 和CH3CH=CH2 | B. | 淀粉和纤维素 | ||
| C. | CH3CH2CH2CH3和CH3CH2CH3 | D. | 乙烷和乙酸 |
 有关物质的转化关系如图所示,固体X由两种常见元素组成,其中一种为常见金属元素,另一种为非金属元素,且质量比为14:1,B是常见的无色无味气体,可以使澄清石灰水变浑浊,C是一种红棕色气体,D是最常见的无色液体,E溶液遇硫氰化钾溶液显血红色,F是紫红色的金属单质,I是常见的无色气体,遇空气变为红棕色.
有关物质的转化关系如图所示,固体X由两种常见元素组成,其中一种为常见金属元素,另一种为非金属元素,且质量比为14:1,B是常见的无色无味气体,可以使澄清石灰水变浑浊,C是一种红棕色气体,D是最常见的无色液体,E溶液遇硫氰化钾溶液显血红色,F是紫红色的金属单质,I是常见的无色气体,遇空气变为红棕色. 