题目内容
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A、标准状况下,22.4L一氯甲烷和二氯甲烷的混合物所含氯原子数介于NA至2NA之间 |
| B、1mol的Cu在一定条件下与足量硫粉反应,转移电子数目为2NA |
| C、3.65g液态氯化氢中分子的数目为0.1NA |
| D、常温下5.6g铁投入到足量的浓硝酸中,转移的电子数为0.3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.标况下二氯甲烷为液体,不能使用标况下的气体摩尔体积计算混合物的物质的量;
B.铜与硫单质反应生成的是硫化亚铜,产物中铜的化合价为+1价;
C.氯化氢的摩尔质量为36.5g/mol,3.65g氯化氢的物质的量为0.1mol;
D.常温下铁与浓硫酸发生钝化,阻止了反应的继续进行.
B.铜与硫单质反应生成的是硫化亚铜,产物中铜的化合价为+1价;
C.氯化氢的摩尔质量为36.5g/mol,3.65g氯化氢的物质的量为0.1mol;
D.常温下铁与浓硫酸发生钝化,阻止了反应的继续进行.
解答:
解:A.二氯甲烷标准状况下为液态,无法计算混合气体中含有的氯原子的范围,故A错误;
B.一定条件下铜与硫反应生成硫化亚铜,1mol铜完全反应失去1mol电子,转移电子数目为NA,故B错误;
C.3.65g氯化氢的物质的量为0.1mol,含有的分子数目为0.1NA,故C正确;
D.常温下,铁与浓硫酸发生了钝化现象,无法计算转移的电子数,故D错误;
故选C.
B.一定条件下铜与硫反应生成硫化亚铜,1mol铜完全反应失去1mol电子,转移电子数目为NA,故B错误;
C.3.65g氯化氢的物质的量为0.1mol,含有的分子数目为0.1NA,故C正确;
D.常温下,铁与浓硫酸发生了钝化现象,无法计算转移的电子数,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的应用,题目难度中等,注意明确标况下二氯甲烷、水、乙醇等物质的状态不是气体,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,现象D为易错点,注意常温下铁与浓硫酸发生钝化.

练习册系列答案
相关题目
下列关于常见有机物的说法中,不正确的是( )
| A、甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 |
| B、乙烯使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色的反应类型不同 |
| C、塑料、合成橡胶、合成纤维都属于合成有机高分子材料 |
| D、化学式均为(C6H10O5)n的淀粉和纤维素互为同分异构体 |
X、Y、Z、W是原子序数依次递增的四种短周期元素,甲、乙、丙、丁是它们两两组合而形成的化合物,且能发生反应:甲+乙→丙+丁,乙、丙、丁的化学式分别为Y2Z、YW2、ZX4,丁是一种常见的液体溶剂,0.1mol/L甲的水溶液的pH为1(25℃).下列说法正确的是( )
| A、原子半径:W>Z>Y>X |
| B、Z元素在周期表的位置为第三周期第ⅡA族 |
| C、丁的稳定性小于甲烷 |
| D、丙的水溶液呈碱性 |
NA表示阿伏加德罗常数值.下列说法正确的是( )
| A、1mol Na2O2与足量CO2充分反应转移的电子数为2NA |
| B、常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA |
| C、向FeI2溶液中通入适量氯气,当有1molFe2+被氧化时,总共转移电子的数目为NA |
| D、t℃时,1L pH=6的纯水中,含1×10-6 NA个OH- |
下列离子方程式书写正确的是( )
| A、Fe(NO3)3加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、硫酸镁溶液与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ |
| C、等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、Cu溶于足量稀硝酸:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |
自保定市被世界自然基金会选定为“中国低碳城市发展项目”的首批试点城市之后,“低碳”已经走进百姓生活、城市建设以及经济发展等各个领域,下列有关说法不正确的是( )
| A、太阳能、地热能、核能等均属于新能源 |
| B、“低碳”是指采用含碳量低的烃类化合物作燃料 |
C、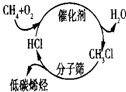 甲烷经一氯甲烷转化成低碳烯烃的途径体现了“节能减排”思想 |
| D、减少化石能源的使用能减少CO2的排放量 |
(A 做)将100mL2.0mol/L的Na2SO4和300mL2.0mol/L的AI2(SO4)3的溶液混合,则混合溶液中SO42-的物质的量浓度约为(假设溶液的体积可以相加)( )
| A、6.0g/mol |
| B、5.0g/mol |
| C、10.0g/mol |
| D、4.0g/mol |
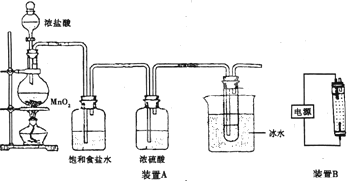
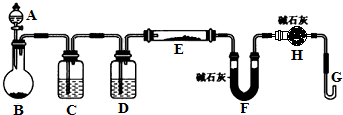 某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题:
某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,如图是测定装置的示意图.A中的试剂是盐酸.请回答下列问题: