题目内容
下列关于化学基本原理和基本概念的几点认识中正确的是( )
| A、胶体区别于其他分散系的本质特征是丁达尔现象 |
| B、强电解质溶液的导电能力强于弱电解质溶液 |
| C、NaCl既可表示氯化钠的组成,又能表示其分子式 |
| D、一般认为沉淀离子浓度小于1.0×10-5mol/L时,则认为已经沉淀完全 |
考点:分散系、胶体与溶液的概念及关系,强电解质和弱电解质的概念
专题:基本概念与基本理论
分析:A.胶体区别于其他分散系的本质特征是粒子直径在1nm~100nm之间;
B.溶液的导电能力和离子浓度呈正比,与电解质的强弱无关;
C.NaCl是氯化钠的化学式,它表示在氯化钠的晶体中钠离子与氯离子的个数比是1:1;
D.当离子浓度小于1.0×10-5mol/L时,可认为完全溶解.
B.溶液的导电能力和离子浓度呈正比,与电解质的强弱无关;
C.NaCl是氯化钠的化学式,它表示在氯化钠的晶体中钠离子与氯离子的个数比是1:1;
D.当离子浓度小于1.0×10-5mol/L时,可认为完全溶解.
解答:
解:A.胶体区别于其他分散系的本质特征是粒子直径在1nm~100nm之间,胶体具有丁达尔效应,但不是本质特,故A错误;
B.溶液的导电能力与溶液中离子浓度成正比,与电解质的强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液强,故B错误;
C.NaCl是氯化钠的化学式,它表示在氯化钠的晶体中钠离子与氯离子的个数比是1:1,晶体中没有分子,故C错误;
D.沉淀不可能完全溶解,当离子浓度小于1.0×10-5mol/L时,可认为完全溶解,故D正确.
故选D.
B.溶液的导电能力与溶液中离子浓度成正比,与电解质的强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液强,故B错误;
C.NaCl是氯化钠的化学式,它表示在氯化钠的晶体中钠离子与氯离子的个数比是1:1,晶体中没有分子,故C错误;
D.沉淀不可能完全溶解,当离子浓度小于1.0×10-5mol/L时,可认为完全溶解,故D正确.
故选D.
点评:本题考查胶体、溶液的导电性、化学用语以及沉淀等,题目难度中等,注意物质的性质,易错点为C,注意氯化钠晶体中没有分子.

练习册系列答案
相关题目
下列反应中,属于加成反应的是( )
| A、CH2=CH2+HCl→CH3CH2Cl | |||
B、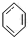 +HO-NO2 +HO-NO2
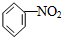 +H2O +H2O | |||
C、CH4+Cl2
| |||
D、2 CH3CH2OH+O2
|
下列关于化学基本概念和基本理论的认识中正确的是( )
| A、用红外光谱分析仪可以确定物质中是否存在C、H、O、N、S、Cl等元素 |
| B、根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等 |
| C、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
| D、一定温度、压强下,一定数量的任何物质的体积由微粒间的平均距离所决定 |
 维生素C(vitaminC)又名L-抗坏血酸,具有有酸性和强还原性,也是一种常见的食品添加剂,其结构如图所示,下列有关说法正确的是( )
维生素C(vitaminC)又名L-抗坏血酸,具有有酸性和强还原性,也是一种常见的食品添加剂,其结构如图所示,下列有关说法正确的是( )| A、维生素C的分子式为C6H10O6 |
| B、维生素C由于含有酯基而难溶于水 |
| C、维生素C由于含有C=O键而能发生银镜反应 |
| D、维生素C的酸性可能是由五元环上的两个羟基引起的 |
下列有关化学用于表示正确的是( )
A、对硝基甲苯的结构简式: | ||
B、CH2F2的电子式: | ||
C、中子数为16的硫原子:
| ||
| D、乙炔的最简式:CH |
实验是化学学习的基础.下列实验叙述正确的是( )
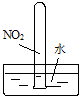 | 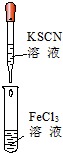 | 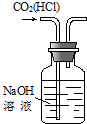 | 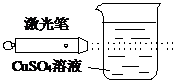 |
| ① | ② | ③ | ④ |
| A、实验①试管最终会充满水 |
| B、实验②试管中溶液变为血红色 |
| C、可用实验③装置除去CO2气体中含有的少量HCl杂质 |
| D、实验④CuSO4溶液中会形成一条光亮的通路 |
向11.2g Fe2O3、Cu的混合物中加入0.25mol?L-1的硫酸溶液600mL时,固体恰好完全溶解,溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
| A、2.4g | B、1.6g |
| C、4.8g | D、6.4g |
下列反应属于氧化还原反应的是( )
| A、Na2O+H2O═2NaOH | ||||
| B、CuSO4+Fe═Cu+FeSO4 | ||||
| C、K2CO3+2HCl═2KCl+H2O+CO2↑ | ||||
D、NH4Cl
|