题目内容
18.下列比较中,正确的是( )| A. | 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的 pH 比 NaCN 溶液大 | |
| B. | 0.2 mol•L-lNH4CI 和 0.l mol•L-lNaOH 溶液等体积混合后:c(NH4+)>c (Cl-)>c (Na+)>c (OH-)>c (H+) | |
| C. | 物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c (Na+)+c(H+)=c (S2-)+c (HS-)+c (OH-) | |
| D. | 同浓度的下列溶液中,①NH4Al(SO4)2②NH4Cl ③CH3COONH4④NH3•H2O; c(NH4+) 由大到小的顺序是:①>②>③>④ |
分析 A.盐对应的酸越弱,对应的酸根离子水解程度越大;
B.0.2mol•L-1NH4Cl和0.1mol•L-1NaOH溶液等体积混合生成NH3•H2O和NaCl,NH3•H2O为弱电解质;
C.从溶液的电中性原则分析;
D.从影响盐类水解的角度分析,NH3•H2O为弱电解质,电离程度较小.
解答 解:A.HF比HCN易电离,NaF比NaCN水解程度大,NaF溶液的pH比NaCN溶液小,故A错误;
B.等体积混合生成NH3•H2O和NaCl,NH3•H2O为弱电解质,只有部分电离,应有c(Cl-)>c(NH4+),故B错误;
C.溶液存在电荷守恒,即阳离子所带正电荷总数等于阴离子所带负电荷总数,所以c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故C错误;
D.①NH4Al(SO4)2中NH4+和Al3+水解都呈酸性,相互抑制,则NH4+水解程度较小,③CH3COONH4中NH4+与CH3COO-水解相互促进,NH4+水解程度较大,则c(NH4+)由大到小的顺序是:①>②>③,NH3•H2O为弱电解质,电离程度较小,c(NH4+)浓度最小,故有c(NH4+)由大到小的顺序是:①>②>③>④,故D正确.
故选D.
点评 本题考查了盐的水解原理、离子浓度大小比较,题目难度中等,本题易错点为D,注意影响离子水解的因素.

练习册系列答案
相关题目
8.向含2mol NaOH、1mol Ba(OH)2、2mol Na[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系不正确的是( )
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
9.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中反应制得:
①3SiO2+6C+2N2$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO,也可由SiCl4的蒸汽和NH3反应制取:
②3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.则下列叙述正确的是( )
①3SiO2+6C+2N2$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO,也可由SiCl4的蒸汽和NH3反应制取:
②3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.则下列叙述正确的是( )
| A. | 反应②属于离子反应 | |
| B. | 若制取等量的Si3N4,则反应①②转移电子数目可能相等 | |
| C. | 反应①的氧化剂是SiO2 | |
| D. | 反应①中氧化产物与还原产物物质的量之比为6:1 |
6.如图所示的某有机反应,其反应类型为( )


| A. | 取代反应 | B. | 加成反应 | C. | 水解反应 | D. | 氧化反应 |
3.同温、同压下等质量的NH3和CH4气体,下列叙述中正确的是( )
①密度之比为17:16 ②体积之比为17:16 ③氢原子个数比为3:4 ④电子数之比为16:17 ⑤原子个数之比为64:85.
①密度之比为17:16 ②体积之比为17:16 ③氢原子个数比为3:4 ④电子数之比为16:17 ⑤原子个数之比为64:85.
| A. | ①③④ | B. | ②④⑤ | C. | ①③ | D. | ①④⑤ |
7.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法表示更便于理解.下列表达正确的是( )
| A. | Na2CO3溶液和盐酸反应后溶液中的钠盐: | |
| B. | NaOH溶液与CO2反应后溶液中的钠盐: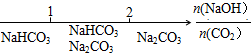 | |
| C. | Fe与稀硝酸反应的氧化产物: | |
| D. | AlCl3溶液中滴加氨水后铝元素的存在形式: |
8.向下列溶液中滴加稀H2S04,一开始出现白色沉淀,继续滴加稀H2S04,沉淀又溶解的是( )
| A. | AlCl3 | B. | NaAl02 | C. | Mgcl2 | D. | BaCl2 |
