题目内容
9.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既是非氧化剂又是非还原剂等.下列反应与Br2+SO2+2H2O═H2SO4+2HBr相比较,水的作用不相同的是( )①2Na+2H2O═2NaOH+H2↑
②4Fe(OH)2+O2+2H2O═4Fe(OH)3
③2F2+2H2O═4HF+O2↑
④Cl2+H2O═HCl+HClO.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
分析 Br2+SO2+2H2O═H2SO4+2HBr中,水中H、O元素的化合价不变,水既不是氧化剂也不是还原剂,以此解答该题.
解答 解:①水中H元素的化合价降低,为氧化剂,故选;
②Fe、O化合价变化,水中各元素的化合价变化,则水既不是氧化剂也不是还原剂,故不选;
③水中O元素的化合价升高,水为还原剂,故选;
④只有Cl元素的化合价变化,水中各元素的化合价变化,则水既不是氧化剂也不是还原剂,故不选.
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意从元素化合价变化的角度分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是614C;
(2)实验室检验Y元素的气态氢化物的方法和现象是用湿润的红色石蕊试纸检验,试纸变蓝;
(3)Z元素与氢元素、氧元素形成的化合物HZO有漂白性,其结构式为H-O-Cl;
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填分子式),理由是H2CO3是弱酸,其余均为强酸;
(5)将T元素的氧化物TO2和Z的单质同时通入水中,可发生反应,该反应化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4.
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的$\frac{3}{8}$ |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)实验室检验Y元素的气态氢化物的方法和现象是用湿润的红色石蕊试纸检验,试纸变蓝;
(3)Z元素与氢元素、氧元素形成的化合物HZO有漂白性,其结构式为H-O-Cl;
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填分子式),理由是H2CO3是弱酸,其余均为强酸;
(5)将T元素的氧化物TO2和Z的单质同时通入水中,可发生反应,该反应化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4.
20.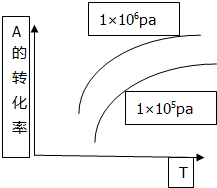 反应mA(g)+B(s)?pC(g)+qD(g)△H>0中A的转化率和温度(T)、压强(P)的关系如图曲线,下列结论正确的是( )
反应mA(g)+B(s)?pC(g)+qD(g)△H>0中A的转化率和温度(T)、压强(P)的关系如图曲线,下列结论正确的是( )
 反应mA(g)+B(s)?pC(g)+qD(g)△H>0中A的转化率和温度(T)、压强(P)的关系如图曲线,下列结论正确的是( )
反应mA(g)+B(s)?pC(g)+qD(g)△H>0中A的转化率和温度(T)、压强(P)的关系如图曲线,下列结论正确的是( )| A. | 逆反应为放热反应m<p+q | B. | 逆反应为吸热反应m>p+q | ||
| C. | 正反应为放热反应m<p+q | D. | 正反应为吸热反应m>p+q |
17.某有机物在氧气中充分燃烧,生成的二氧化碳和水的物质的量之比为1:1,由此可得出的正确结论是( )
| A. | 该有机物分子中碳、氢、氧原子个数比为1:2:3 | |
| B. | 该有机物分子中碳、氢原子个数比为1:2 | |
| C. | 该有机物中肯定含氧 | |
| D. | 可以判断该有机物中是否含氧 |
14.北京和张家口市联合申办2022年冬奥会,目前北京市政府正在全力改善空气质量.以下不在空气质量报告范围内的是( )
| A. | 二氧化硫(SO2) | B. | 总悬浮颗粒物(TSP) | C. | 二氧化氮(NO2) | D. | 二氧化碳(CO2) |
1.下列说法正确的是( )
| A. | 有机物中都存在同分异构现象 | |
| B. | 14C和14Si是同位素 | |
| C. | C2H5Cl没有同分异构体 | |
| D. | 只要含有的官能团种类相同就是同系物 |
18.下列物质中属于电解质的是( )
| A. | H2 | B. | Na2SO4 | C. | C2H5OH | D. | CO2 |
19.下列药品保存方法不正确的是( )
| A. | 浓HNO3和AgNO3溶液都要避光密封保存 | |
| B. | 保存氯化铁和氯化亚铁试剂都要加盐酸和铁粉 | |
| C. | 少量的金属钠、钾、白磷和液溴都要用液封法保存 | |
| D. | 碱性较强的溶液都要保存在配有胶塞的细口试剂瓶中 |
 读图题:已知1-丙醇和2-丙醇的结构简式如下:
读图题:已知1-丙醇和2-丙醇的结构简式如下: