题目内容
下列操作会使H2O的电离平衡向正方向移动,且所得溶液呈酸性的是( )
| A、向水中加入少量的CH3COONa |
| B、向水中加入少量的NaHSO4 |
| C、向水中加入NaI并加热至100℃,pH=6 |
| D、向水中加少量的KAl(SO4)2 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:使H2O的电离平衡向正方向移动,且所得溶液呈酸性,说明该物质是强酸弱碱盐,促进水电离.
解答:
解:使H2O的电离平衡向正方向移动,且所得溶液呈酸性,说明该物质是强酸弱碱盐,
A.根据水的电离平衡H2O=H++OH-知,加入少量CH3COONa促进了水的电离,向正方向移动,但溶液呈碱性,故A错误;
B.硫酸氢钠抑制了的水的电离,向逆方向移动,溶液呈酸性,故B错误;
C.加入NaI对水的电离无影响,加热促进水的电离,向正方向移动,虽然PH=6,但溶液仍然呈中性,故C错误;
D.加入少量的KAl(SO4)2,铝离子水解导致溶液呈酸性,促进水电离,故D正确;
故选D.
A.根据水的电离平衡H2O=H++OH-知,加入少量CH3COONa促进了水的电离,向正方向移动,但溶液呈碱性,故A错误;
B.硫酸氢钠抑制了的水的电离,向逆方向移动,溶液呈酸性,故B错误;
C.加入NaI对水的电离无影响,加热促进水的电离,向正方向移动,虽然PH=6,但溶液仍然呈中性,故C错误;
D.加入少量的KAl(SO4)2,铝离子水解导致溶液呈酸性,促进水电离,故D正确;
故选D.
点评:本题考查了弱电解质的电离,明确影响水电离的因素及盐的特点是解本题关键,易错选项是C,注意NaI是强酸强碱盐,无论水的电离程度越大,纯水溶液或强酸强碱盐溶液都呈中性,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
化学与生产、生活密切相关,下列叙述正确的是( )
| A、棉、麻、丝、毛,完全燃烧都只生成CO2和H2O |
| B、煤的干馏和石油的分馏均为物理变化 |
| C、制作快餐盒的聚苯乙烯塑料是易降解塑料 |
| D、“地沟油”经加工处理后可以制肥皂和生物柴油 |
等体积等物质的量浓度的四种溶液:①(NH4)2SO4溶液②NH4Cl溶液③CH3COONH4溶液④(NH4)2Fe(SO4)2溶液,下列有关四种溶液的说法正确的是( )
| A、常温下,测得③溶液的pH=7,说明该溶液中的CH3COO-与NH4+没有发生水解 |
| B、这四种溶液中c(NH4+)大小顺序为:④>①>③>② |
| C、向②溶液中加一定量的浓氨水,可能会出现:c(NH4+)═c(Cl-) |
| D、向盛有少量苯酚溶液的试管中滴加几滴④溶液,可以看到溶液呈紫色 |
常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是( )
| A、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) |
| B、0.1 mol?L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C、0.1 mol?L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-) |
| D、0.01 mol?L-1 NaOH溶液与等体积pH=2的醋酸混合后的溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
下列说法正确的是( )
| A、在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(OH-)减小 |
| B、反应Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)在常温下不能自发进行,则△H<0 |
| C、工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应 |
| D、在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
某有机物的分子式为C9H9ClO2,分子中含有1个苯环,苯环上有两个取代基,并能与NaHCO3溶液反应的同分异构体的数目为(不考虑立体异构)( )
| A、12种 | B、15种 |
| C、18种 | D、21种 |

 ),该反应属于
),该反应属于
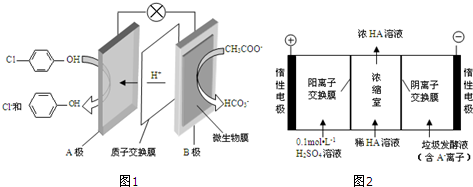
 )的废水可以利用微生物电池除去,其原理如图1所示.
)的废水可以利用微生物电池除去,其原理如图1所示.