题目内容
14.下列说法正确的是( )| A. | 标准状况下,1mol水的体积约是22.4升 | |
| B. | 1molH2所占的体积约是22.4升 | |
| C. | 标准状况下,6.02×1023个分子所占的体积约是22.4升 | |
| D. | 标准状况下,28g氮气和CO的混合气体的体积约是22.4升 |
分析 A.标准状况下,水的状态不是气体;
B.没有指出在标准状况下,不能使用标准状况下的气体摩尔体积计算;
C.没有指出是气体,不能使用22.4L/mol计算;
D.标准状况下,气体摩尔体积为22.4L/mol,根据n=$\frac{m}{M}$计算出混合气体的物质的量,最高价V=nVm计算出混合气体的体积.
解答 解:A.标准状况下水不是气态,不能使用标准状况下的气体摩尔体积计算,故A错误;
B.没有告诉在标准状况下,不能使用22.4L/mol计算,故B错误;
C.6.02×1023个分子的物质的量为1mol,但是没有告诉物质状态,不能使用标准状况下的气体摩尔体积计算,故C错误;
D.28g氮气和CO的混合气体的物质的量为:$\frac{28g}{28g/mol}$=1mol,标准状况下1mol混合气体的体积约为22.4L,故D正确;
故选D.
点评 本题考查了物质的量与气体摩尔体积的综合应用,题目难度不大,明确标准状况下气体摩尔体积的使用条件为解答关键,注意掌握物质的量与气体摩尔体积的关系,试题培养了学生的化学计算能力.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
8.下列关于甲烷的说法中,不正确的是( )
| A. | 是天然气的主要成分 | B. | 甲烷是正四面体型分子 | ||
| C. | 分子中C的质量分数为75% | D. | 甲烷不能发生氧化反应 |
5.(CH3)2CHC(C2H5)2C(CH3)2C2H5 的正确命名是( )
| A. | 2,4-三甲基-3,3-二乙基己烷 | |
| B. | 3,3,5-甲基-4,4-二乙基己烷 | |
| C. | 3,3,-二甲基-3-乙基-3-异丙基己烷 | |
| D. | 2,4,4-三甲基-3,3-二乙基己烷 |
2.在图中的8个装置中,能构成原电池的是( )


| A. | ①③④ | B. | ④⑦ | C. | ④⑥⑦ | D. | ①⑦⑧ |
9.设NA从为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 18g重水含有10NA 个电子 | |
| B. | 室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数约为3 NA | |
| C. | 常温下0.05 mol•L-1Fe2(S04 ) 3溶液中含Fe 3+数目小于0.1NA | |
| D. | 用惰性电极电解饱和食盐水,当阴极得到2NA个电子时阳极产生22.4 L气体 |
19.部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是( )

下列说法正确的是( )
| A. | V=896 | B. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | ||
| C. | 样品中CuO的质量为4.0g | D. | 样品中Fe元素的质量为2.24g |
4.核素钬67166Ho的中子数为( )
| A. | 166 | B. | 99 | C. | 67 | D. | 32 |
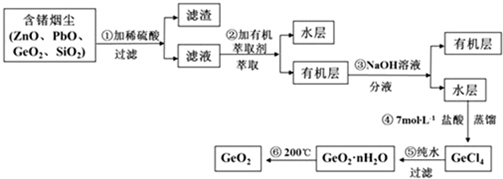
 (3)第④步加入盐酸作用中和NaOH,作反应物,抑制GeCl4水解(答两点即可).
(3)第④步加入盐酸作用中和NaOH,作反应物,抑制GeCl4水解(答两点即可).