题目内容
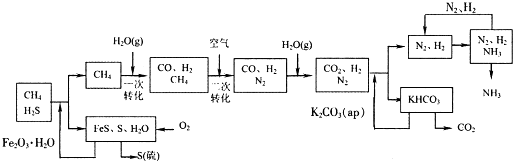
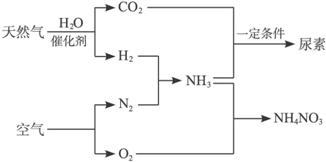
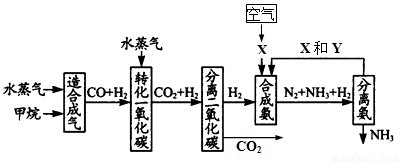
25.以天然气为原料合成氨是新的生产氮肥的方法,它具有污染小、成本低等诸多特点,其过程大体如下:

某工厂以标准状况下的含CH4 89.6%的天然气100 m3为原料经过上述过程,生产尿素和硝酸铵。
⑴ 合成氨生产过程中氨的产率为60%,假设其它各步反应均完全且不考虑副反应,求100 m3的天然气可生产尿素的质量。
⑵ 为使硝酸生产过程中不再补充空气,假设各步反应均完全且氨中氮元素全部转化为HNO3,空气中氧气的体积分数设为20%,求由氨气和空气组成的原料气中 (不包含被硝酸吸收的氨气)氨气与空气的体积比。
⑶ 实际生产中,若氨的产率为60%,硝酸的产率为80%,求100 m3的天然气最多可生产硝酸铵的质量。
(注:产率=×100%)
(1) 192 kg
(2) 1∶10
(3) 227.6 kg (2分)
解析:
(1)CH4 +2H2O![]() CO2 +4H2 3H2 +N2
CO2 +4H2 3H2 +N2![]() 2NH3 2NH3 +CO2 ==CO(NH2)2 +H2O
2NH3 2NH3 +CO2 ==CO(NH2)2 +H2O
CH4: =4000 mol
CH4 ~4H2 ~8/3 NH3
合成氨的物质的量为:4000 mol ×8/3×60%=6400 mol (3分)
2NH3 ~CO(NH2)2
生产尿素的质量为:
6400 mol×1/2×60 g/mol= 192000 g =192 kg (2分)
(2) 4NH3 +5O2 ![]() 4NO + 6H2O 2NO + O2 =2NO2 3NO2 +2 H2O =2HNO3 +NO
4NO + 6H2O 2NO + O2 =2NO2 3NO2 +2 H2O =2HNO3 +NO
氨中氮元素全部转化为HNO3 ,则5NH3 ~10 O2
V(NH3 )∶V(空气)=5∶10/20%==1∶10 (3分)
(3)NH3 + HNO3 =NH4NO3
设用于生产硝酸的氨的物质的量为x
6400 mol-x == x×80% x=3555.6 mol
NH4NO3 的质量为 3555.6 mol×80%×80 g/mol = 227558.4 g ==227.6 kg (2分)