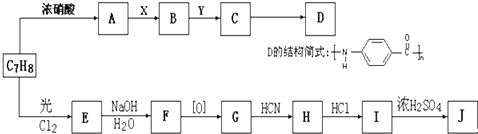
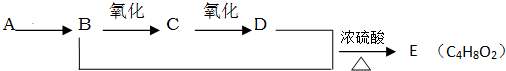
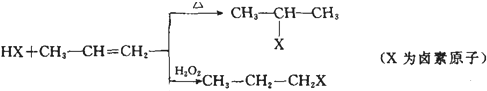
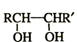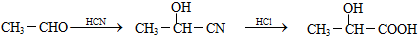题目内容
盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐).实验室以盐泥为原料制取MgSO4?7H2O的实验过程如下:

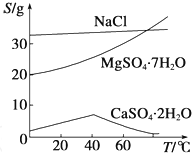
已知:①室温下Ksp[Mg(OH)2]=6.0×10-12.②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7.③三种化合物的溶解度(S)随温度变化的曲线如图所示.
(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是 .
(2)若室温下的溶液中Mg2+的浓度为6.0mol?L-1,则溶液pH≥ 才可能产生Mg(OH)2沉淀.
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是 ,滤渣的主要成分是 .
(4)从滤液Ⅱ中获得MgSO4?7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入 ;②过滤,得沉淀;③ ;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品.
(5)若获得的MgSO4?7H2O的质量为24.6g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为 (MgSO4?7H2O的相对分子质量为246).

已知:①室温下Ksp[Mg(OH)2]=6.0×10-12.②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7.③三种化合物的溶解度(S)随温度变化的曲线如图所示.

(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是
(2)若室温下的溶液中Mg2+的浓度为6.0mol?L-1,则溶液pH≥
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是
(4)从滤液Ⅱ中获得MgSO4?7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入
(5)若获得的MgSO4?7H2O的质量为24.6g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:盐泥主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐),加入稀硫酸,硅酸盐生成硅酸沉淀,碳酸盐生成二氧化碳气体和阳离子,过滤除去难溶性物质.滤液Ⅰ中含Fe2+、Fe3+、Al3+、H+、Mg2+、Ca2+等阳离子;滤液Ⅰ到滤液Ⅱ需除去Fe2+、Fe3+、Al3+、H+、Ca2+,只保留Mg2+;
(1)根据离子完全沉淀的pH值来确定在盐泥中加入稀硫酸调pH为1~2并煮沸的目的;
(2)根据氢氧化镁的Ksp=c(Mg2+)?c(OH-)2来计算;
(3)根据三种化合物的溶解度(S)随温度变化的曲线来回答;滤渣的成分根据加入次氯酸钠发生发生反应考虑;
(4)镁离子可以和氢氧化钠发生反应生成氢氧化镁沉淀,过滤,得到纯净的沉淀,再加入硫酸,蒸发结晶可以获得硫酸镁晶体;
(5)根据镁元素守恒结合关系式:MgSO4?7H2O-Mg(OH)2进行计算.
(1)根据离子完全沉淀的pH值来确定在盐泥中加入稀硫酸调pH为1~2并煮沸的目的;
(2)根据氢氧化镁的Ksp=c(Mg2+)?c(OH-)2来计算;
(3)根据三种化合物的溶解度(S)随温度变化的曲线来回答;滤渣的成分根据加入次氯酸钠发生发生反应考虑;
(4)镁离子可以和氢氧化钠发生反应生成氢氧化镁沉淀,过滤,得到纯净的沉淀,再加入硫酸,蒸发结晶可以获得硫酸镁晶体;
(5)根据镁元素守恒结合关系式:MgSO4?7H2O-Mg(OH)2进行计算.
解答:
解:(1)根据离子完全沉淀的pH值可以知道,在盐泥中加入稀硫酸调pH为1~2并煮沸的目的是为了提高Mg2+的浸取率,故答案为:为了提高Mg2+的浸取率;
(2)氢氧化镁的Ksp=c(Mg2+)?c(OH-)2,溶液中Mg2+的浓度为6.0mol?L-1,则溶液的氢氧根浓度=
mol/L=10-6mol/L,所以氢离子浓度为
=10-8mol/L,pH为8,故答案为:8;
(3)根据三种化合物的溶解度(S)随温度变化的曲线,可以知道高温下CaSO4?2H2O溶解度小,温度较高时钙盐与镁盐分离得更彻底;由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,把亚铁离子氧化成铁离子,同时铁离子、铝离子形成氢氧化铁、氢氧化铝沉淀、硫酸钙沉淀,所得到的滤渣主要成分是:Al(OH)3、Fe(OH)3、CaSO4?2H2O,
故答案为:温度较高时钙盐与镁盐分离得更彻底(或高温下CaSO4?2H2O溶解度小等合理答案均可);Al(OH)3、Fe(OH)3、CaSO4?2H2O;
(4)镁离子可以和氢氧化钠发生反应生成氢氧化镁沉淀,过滤,得到纯净的沉淀,再加入硫酸,蒸发结晶可以获得硫酸镁晶体,故答案为:NaOH溶液;向沉淀中加足量稀硫酸;
(5)设该盐泥中含Mg(OH)2的质量为x,MgSO4?7H2O质量为24.6克,物质的量是
=0.1mol.
由关系式MgSO4?7H2O-Mg(OH)2
1mol 58g
0.1mol x
x=5.8g
故该盐泥中含Mg(OH)2的百分含量为
×100%=20%,
故答案为:20.0%.
(2)氢氧化镁的Ksp=c(Mg2+)?c(OH-)2,溶液中Mg2+的浓度为6.0mol?L-1,则溶液的氢氧根浓度=
|
| 1×10-14 |
| 10-6 |
(3)根据三种化合物的溶解度(S)随温度变化的曲线,可以知道高温下CaSO4?2H2O溶解度小,温度较高时钙盐与镁盐分离得更彻底;由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,把亚铁离子氧化成铁离子,同时铁离子、铝离子形成氢氧化铁、氢氧化铝沉淀、硫酸钙沉淀,所得到的滤渣主要成分是:Al(OH)3、Fe(OH)3、CaSO4?2H2O,
故答案为:温度较高时钙盐与镁盐分离得更彻底(或高温下CaSO4?2H2O溶解度小等合理答案均可);Al(OH)3、Fe(OH)3、CaSO4?2H2O;
(4)镁离子可以和氢氧化钠发生反应生成氢氧化镁沉淀,过滤,得到纯净的沉淀,再加入硫酸,蒸发结晶可以获得硫酸镁晶体,故答案为:NaOH溶液;向沉淀中加足量稀硫酸;
(5)设该盐泥中含Mg(OH)2的质量为x,MgSO4?7H2O质量为24.6克,物质的量是
| 24.6g |
| 246g/mol |
由关系式MgSO4?7H2O-Mg(OH)2
1mol 58g
0.1mol x
x=5.8g
故该盐泥中含Mg(OH)2的百分含量为
| 5.8 |
| 29 |
故答案为:20.0%.
点评:本题是一道物质的分离和提纯知识的综合实验题,考查学生分析和解决问题的能力,综合性强,难度较大.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
下列实验现象及相关的离子方程式均正确的是( )
| A、C12与FeI2溶液反应,当以n(C12):n(FeI2)=1:1时:2Fe2++2I-+2C12=2Fe3++I2+4Cl- |
| B、向Ba(NO3)2溶液中通入S02气体,出现白色沉淀:Ba2++SO2+H2O═BaSO3↓+2H+ |
| C、向H2O2 溶液中滴加酸化的KMnO4 溶液,KMnO4 溶液褪色:2MnO4?+7H2O2+6H+═2 Mn2++6O2↑+10H2O |
| D、将等物质的量浓度、等体积的Ba(OH)2溶液和NaHS04溶液混合:Ba2++SO42?+H++OH?═BaSO4↓+H2O |