题目内容
NA为阿伏伽德罗常数,下列叙述不正确的是( )
| A、80g硝酸铵中含有氮原子数为NA |
| B、0.lmolN5+离子中所含的电子数为3.4NA |
| C、1mol甲烷和NA个甲烷分子的质量相等 |
| D、16g氧气和16g臭氧所含的原子数均为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、根据n=
并结合硝酸铵 的化学式来计算;
B、根据N5+是N5失去一个电子从而形成的来分析;
C、1mol甲烷即NA个甲烷分子;
D、根据n=
并结合氧气和臭氧的分子式来计算.
| m |
| M |
B、根据N5+是N5失去一个电子从而形成的来分析;
C、1mol甲烷即NA个甲烷分子;
D、根据n=
| m |
| M |
解答:
解:A、根据n=
可知80gNH4NO3的物质的量n=
=1mol,而1molNH4NO3含2mol氮原子,故80g硝酸铵中含有氮原子数为2NA,故A错误;
B、N5+是N5失去一个电子从而形成的,故1molN5+含34mol电子,故0.lmolN5+离子中所含的电子数为3.4NA,故B正确;
C、1mol甲烷即NA个甲烷分子,故1mol甲烷和NA个甲烷分子的质量相等,故C正确;
D、16gO2的物质的量n=
=
=0.5mol,故含有的氧原子数N=0.5mol×2×NA=NA;16gO3的物质的量n=
=
=
mol,故含有的氧原子数N=
mol×3NA=NA;故D正确.
故选A.
| m |
| M |
| 80g |
| 80g/mol |
B、N5+是N5失去一个电子从而形成的,故1molN5+含34mol电子,故0.lmolN5+离子中所含的电子数为3.4NA,故B正确;
C、1mol甲烷即NA个甲烷分子,故1mol甲烷和NA个甲烷分子的质量相等,故C正确;
D、16gO2的物质的量n=
| m |
| M |
| 16g |
| 32g/mol |
| m |
| M |
| 16g |
| 48g/mol |
| 1 |
| 3 |
| 1 |
| 3 |
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,在掌握公式的使用的基础上熟悉物质的分子组成是解题关键.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) 2HI(g);(正反应为吸热反应),当达到平衡后,t0时升高温度,下列说法正确的是( )
| A、容器内气体颜色变深,平均相对分子质量不变 |
| B、平衡不移动,混合气体密度增大 |
| C、H2转化率增大,HI平衡浓度变小 |
D、 改变条件前后,速率图象为(如图) |
下列说法正确的是( )
| A、某烷烃命名为2,3,4-三甲基-3,5-二乙基己烷 |
B、结构片段为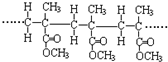 的高聚物,是其单体通过缩聚反应生成 的高聚物,是其单体通过缩聚反应生成 |
C、等物质的量的Na、NaOH、NaHCO3分别与足量的有机物 (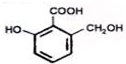 )充分反应,消耗该有机物的物质的量之比为3:2:1 )充分反应,消耗该有机物的物质的量之比为3:2:1 |
D、化合物 在酸性条件下加热水解,所得溶液加碱后加热有NH3生成 在酸性条件下加热水解,所得溶液加碱后加热有NH3生成 |
下列排列顺序错误的是( )
| A、金属性 Rb>K>Mg>Al |
| B、非金属性 As>S>Cl>F |
| C、稳定性 AsH3>PH3>H2S>HF |
| D、半径 Na>P>O>F |
有2份质量分数不同的NaHCO3和NaOH的混合物,将它们分别用酒精灯隔绝空气加热至恒重并排出气体后恢复到常温,测得的数据如下:则下列叙述不正确的是( )
| 第1份 | 第2分 | |
| 混合物质量(g) | 9.2 | 20.8 |
| 反应后固体质量(g) | 8.3 | 15.9 |
| A、第二份得到的反应后固体是纯净物 |
| B、第1份混合物中NaOH的质量分数更大 |
| C、根据表中数据不能计算出第1份混合物中NaHCO3的质量分数 |
| D、第2份混合物中NaOH的物质的量小于NaHCO3的物质的量 |
下列有关物质的性质或应用的说法正确的是( )
| A、石油裂化可获得乙烯、丙烯和丁二烯 |
| B、石油裂解的目的主要是为了得到更多的汽油 |
| C、盐析可用于提纯蛋白质并保持其生理活性 |
| D、木糖醇(C5H12O5)是一种甜味剂,它属于多羟基化合物,与葡萄糖互为同系物 |
日本福岛第一核电站泄漏出微量的钚(Pu)-239.
Pu原子的核外电子数为( )
239 94 |
| A、51 | B、94 |
| C、145 | D、239 |
某同学对一些科学符号中数字的含义有如下的理解,其中错误的是( )
| A、O2:可表示一个氧气分子中有2个氧原子 |
| B、2C:可表示两个碳原子 |
| C、S2-:可表示一个硫离子带2个单位负电荷 |
| D、NH3:可判断出该物质中N、H元素的个数比为1:3 |
下列物质中,长久露置于空气中会发生颜色变化的是( )
①绿矾 ②氢氧化亚铁 ③氯水 ④石炭酸 ⑤亚硫酸钠 ⑥过氧化钠.
①绿矾 ②氢氧化亚铁 ③氯水 ④石炭酸 ⑤亚硫酸钠 ⑥过氧化钠.
| A、全部 | B、①②③④⑥ |
| C、只有①②③ | D、只有②③④ |