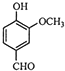
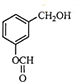
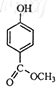
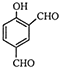
题目内容
下列叙述正确的是( )
| A、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
| B、CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大 |
| C、Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2 |
| D、25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度 |
考点:影响盐类水解程度的主要因素,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A、浓氨水和氯化铁之间会发生复分解反应;
B、醋酸钠中加入盐酸会发生反应生成醋酸和氯化钠;
C、Ca(HCO3)2溶液与过量NaOH溶液反应产物是碳酸钙和碳酸钠;
D、根据沉淀溶解平衡的影响因素来回答判断.
B、醋酸钠中加入盐酸会发生反应生成醋酸和氯化钠;
C、Ca(HCO3)2溶液与过量NaOH溶液反应产物是碳酸钙和碳酸钠;
D、根据沉淀溶解平衡的影响因素来回答判断.
解答:
解:A、浓氨水和氯化铁之间会发生复分解反应生成氢氧化铁沉淀和氯化铵,不会获得胶体,故A错误;
B、醋酸钠中加入盐酸会发生反应生成醋酸和氯化钠,所以醋酸根离子浓度会减小,故B错误;
C、Ca(HCO3)2溶液与过量NaOH溶液反应产物是碳酸钙和碳酸钠,并不会获得氢氧化钙,故C错误;
D、氢氧化铜存在沉淀溶解平衡Cu(OH)2?Cu2++2OH-,Cu(NO3)2溶液中铜离子会抑制沉淀溶解平衡的右移,所以Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度,故D正确.
故选D.
B、醋酸钠中加入盐酸会发生反应生成醋酸和氯化钠,所以醋酸根离子浓度会减小,故B错误;
C、Ca(HCO3)2溶液与过量NaOH溶液反应产物是碳酸钙和碳酸钠,并不会获得氢氧化钙,故C错误;
D、氢氧化铜存在沉淀溶解平衡Cu(OH)2?Cu2++2OH-,Cu(NO3)2溶液中铜离子会抑制沉淀溶解平衡的右移,所以Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度,故D正确.
故选D.
点评:本题考查学生物质的性质以及沉淀溶解平衡的影响因素等方面的知识,注意知识的归纳和整理是解题关键,难度中等.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
如图所示的五中元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22,下列说法正确的是( )
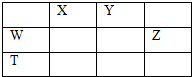

| A、X、Y、Z三种元素最低价氢化物的沸点依次升高 |
| B、由X、Y和氢三种元素形成的化合物中只有共价键 |
| C、物质WY2,W3X4,WZ4均有熔点高,硬度大的特性 |
| D、T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价.下列说法正确的是( )
| A、XH4的沸点比YH3高 |
| B、X与W形成的化合物和Z与W形成的化合物的化学键类型相同 |
| C、元素Y与W形成的化合物溶于水后具有漂白性 |
| D、X与Y形成的化合物可能是离子晶体 |
一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g)
下列说法正确的是( )
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A、该反应的正反应为放热反应 |
| B、达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小 |
| C、容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长 |
| D、若起始时向容器Ⅰ中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行 |
除去下列物质中的少量杂质,正确的是( )
| 选项 | 混合物 | 所用试剂 | 方法 |
| A | 乙酸乙酯和乙酸溶液 | 饱和Na2CO3溶液 | 分液 |
| B | 苯中的甲苯 | 溴水 | 分液 |
| C | 溴苯中的溴 | KI溶液 | 分液 |
| D | 乙烯中的SO2 | 溴水 | 洗气 |
| A、A | B、B | C、C | D、D |
水溶液中能大量共存的一组离子是( )
| A、Na+、Ca2+、Cl-、SO42- |
| B、Fe2+、H+、SO32-、ClO- |
| C、Mg2+、NH4+、Cl-、SO42- |
| D、K+、Fe3+、NO3-、SCN- |