题目内容
4.钠及其重要化合物之间的转化关系如图所示: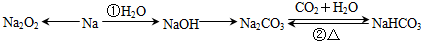
回答下列问题:
(1)Na2O2的颜色为淡黄色.
(2)反应①钠与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑.
(3)反应②NaHCO3受热分解的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
分析 (1)依据过氧化钠为淡黄色固体的物理性质解答;
(2)钠与水反应生成氢氧化钠和氢气;
(3)碳酸氢钠受热分解生成碳酸钠和水、二氧化碳.
解答 解:(1)过氧化钠为淡黄色固体;
故答案为:淡黄色;
(2)钠与水反应生成氢氧化钠和氢气,离子方程式:2Na+2H2O=2NaOH+H2↑;
故答案为:2Na+2H2O=2NaOH+H2↑;
(3)碳酸氢钠受热分解生成碳酸钠和水、二氧化碳,化学方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2↑;
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2↑.
点评 本题考查了元素化合物知识,侧重考查化学方程式的书写,明确物质的性质是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列溶液中氯离子浓度最大的是( )
| A. | 100 mL 0.8 mol•L-1MgCl2溶液 | B. | 50 mL 0.5 mol•L-1AlCl3溶液 | ||
| C. | 200 mL 1 mol•L-1NaCl溶液 | D. | 200 mL 2 mol•L-1KClO3溶液 |
19.在实验室中,通常将金属钠保存在( )
| A. | 自来水中 | B. | 煤油中 | C. | 食盐水 | D. | 沙子中 |
9.25℃时,浓度均为0.1mol•L-1的HA溶液和BOH溶液,pH分别是1和11.下列说法正确的是( )
| A. | 在0.1 mol•L-1BA溶液中c(A-)+c(H+)=c(BOH)+c(OH-) | |
| B. | 若将0.1 mol•L-1BOH溶液稀释至0.001 mol•L-1则溶液的pH=9 | |
| C. | 若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) | |
| D. | 若将上述两溶液按体积比1:2混合,则混合液中:c(B+)>c(A-)>c(OH-)>c(H+) |
16.下列溶液中有关粒子的物质的量浓度关系正确的是( )
| A. | 氯水中:2c(Cl2)═c(ClO-)+c(Cl-)+c(HClO) | |
| B. | 25℃时,pH=12的NaOH溶液与pH=12的氨水;c(Na+)═c(NH4+) | |
| C. | pH=4的0.1 mol•L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| D. | 在K2CO3溶液中:c(CO32-)+c(H+)═c(HCO3-) |
14.下列各组离子能在溶液中大量共存的是( )
| A. | K+、Na+、Cl-、NO3- | B. | Fe3+、K+、Br-、SCN- | ||
| C. | NH4+、Na+、CO32-、OH- | D. | Al3+、Mg2+、SO42-、HCO3- |


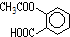 ,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
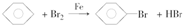 (催化剂也可以写FeBr3).
(催化剂也可以写FeBr3).