题目内容
12.若用NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 22.4 L NH3中含氮原子数为 NA | |
| B. | 1 mol Na2O2与水完全反应时转移的电子数为NA | |
| C. | 100 mL 2.0 mol•L-1 NH4HCO3溶液中NH4+数为0.2NA | |
| D. | 1 mol O2和2 mol SO2在密闭容器中充分反应后的分子数等于2NA |
分析 A、氨气所处的状态不明确;
B、过氧化钠与水的反应为歧化反应;
C、NH4+为弱碱阳离子,在溶液中能水解;
D、氧气和二氧化硫的反应为可逆反应.
解答 解:A、在没有标明压强与温度的情况下气体的体积没有意义,无法计算其物质的量,故A错误;
B、Na2O2与水反应发生自身氧化还原反应,1 mol Na2O2转移的电子数为NA,故B正确;
C、NH4HCO3溶液中NH4+部分水解,故溶液中的铵根离子的个数小于0.2NA个,故C错误;
D、两者发生可逆反应2SO2+O2 2SO3,不可能进行到底,故反应后容器中的分子个数大于2NA个,故D错误.
2SO3,不可能进行到底,故反应后容器中的分子个数大于2NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
7.三草酸合铁酸钾晶体K3[Fe(C2O4)3]?3H2O可用于摄影和蓝色印刷.某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究.请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程.
限选试剂:浓硫酸、1.0mol•L-1HNO3、1.0mol•L-1盐酸、1.0mol•L-1NaOH、3% H2O2、0.1mol•L-1 KI、0.1mol•L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是利用焰色反应,现象是透过蓝色钴玻璃,观察到紫色的火焰.
(2)固体产物中铁元素存在形式的探究.
①提出合理假设
假设1:全部是铁单质;
假设2:全部为FeO;
假设3:同时存在铁单质和FeO.
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验.在答题卡上按下表的格式写出实验步骤、预期现象与结论.
限选试剂:浓硫酸、1.0mol•L-1HNO3、1.0mol•L-1盐酸、1.0mol•L-1NaOH、3% H2O2、0.1mol•L-1 KI、0.1mol•L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是利用焰色反应,现象是透过蓝色钴玻璃,观察到紫色的火焰.
(2)固体产物中铁元素存在形式的探究.
①提出合理假设
假设1:全部是铁单质;
假设2:全部为FeO;
假设3:同时存在铁单质和FeO.
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验.在答题卡上按下表的格式写出实验步骤、预期现象与结论.
| 实验步骤 | 预期现象与结论 |
| 步骤1: | 部分固体不溶解 |
| 步骤2: | |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色.取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN. |
17.如表中评价合理的是( )
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | FeO与足量的稀硝酸反应: FeO+2H+═Fe2++H2O | 正确 |
| B | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO42-═BaSO4↓ | 正确 |
| C | 碳酸氢钠溶液中滴加少量的石灰水: 2HCO3-+Ca2++2OH-═CO32-+CaCO3↓+2H2O | 错误,HCO3-、OH-和H2O的系数应均为1,生成物中没有CO32- |
| D | 用食醋除去水瓶中的水垢: CaCO3+2H+═Ca2++H2O+CO2↑ | 错误,醋酸是弱酸,不应写成H+形式 |
| A. | A | B. | B | C. | C | D. | D |
4.下列各组离子在指定条件下一定不能大量共存的是( )
| A. | 加入较多NaHSO4的溶液中:Fe3+、Cl-、NO3-、Na+ | |
| B. | 通入大量CO2气体的溶液中:Na+、Ba2+、Cl-、NO3- | |
| C. | 通入大量NH3的溶液中:Ca2+、Na+、HCO3-、Cl- | |
| D. | 通入大量SO2气体的溶液中:Na+、SO32-、NH4+、SO42- |
2.下列说法正确的是( )
| A. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8 kJ•mol-1,则H2的燃烧热为-285.8 kJ•mol-1 | |
| B. | 已知:S(g)+O2(g)═SO2(g)△H1=-Q1;S(s)+O2(g)═SO2(g)△H2=-Q2,则Q1<Q2 | |
| C. | 已知:$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H1; CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l)△H2,则有|△H1|<|△H2| | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0 kJ•mol-1 CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 C(石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 则4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1641.0 kJ•mol-1 |
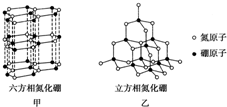 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,只有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,只有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.