题目内容
一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是
A.次磷酸的电离方程式为H3PO2 3H++PO23-
3H++PO23-
B.次磷酸中P的化合价为+1
C.NaH2PO2是酸式盐
D.NaH2PO2溶液显弱酸性
B
【解析】
试题分析:次磷酸(H3PO2)是 一元中强酸,电离方程式应该用等号,而且只能电离产生1个H+,电离方程式是:H3PO2 H++H2PO2-,错误;B.根据在化合物中元素的正负化合价的代数和为0的原则,结合H的化合价是+1价,O的化合价是-2价,可知在次磷酸中P的化合价为+1,正确;C.由于次磷酸(H3PO2)是 一元中强酸,所以NaH2PO2是正盐,错误;D.NaH2PO2是强碱弱酸盐,弱酸根离子H2PO2-水解消耗水电离产生的H+,破坏了水的电离平衡,最终当溶液达到平衡时,c(OH-)>c(H+),所以溶液显弱碱性,错误。
H++H2PO2-,错误;B.根据在化合物中元素的正负化合价的代数和为0的原则,结合H的化合价是+1价,O的化合价是-2价,可知在次磷酸中P的化合价为+1,正确;C.由于次磷酸(H3PO2)是 一元中强酸,所以NaH2PO2是正盐,错误;D.NaH2PO2是强碱弱酸盐,弱酸根离子H2PO2-水解消耗水电离产生的H+,破坏了水的电离平衡,最终当溶液达到平衡时,c(OH-)>c(H+),所以溶液显弱碱性,错误。
考点:考查次磷酸中元素的化合价、溶液的酸碱性、电离方程式的书写及盐的分类判断的知识。

下述根据下列操作和现象,所得结论正确的是
实验操作及现象 | 实验结论 | |
A | 分别向2 mL 0.1 mol·L-1 CH3COOH溶液和2 mL 0.1 mol·L-1 H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性: CH3COOH > H2CO3> H3BO3 |
B | 向浓度均为0.1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液,产生黄色沉淀 | 溶度积: Ksp(AgCl)<Ksp(AgI) |
C | 向无水乙醇中加入浓H2SO4,加热,产生的气体通入酸性KMnO4溶液,紫色褪去 | 证明生成了乙烯 |
D | 将少量的溴水滴入NaI溶液中,再滴加CCl4,振荡、静置,溶液分为两层:上层溶液无色,下层溶液紫红色 | 氧化性:Br2>I2 |
 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示: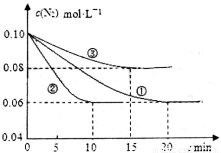
 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。 CH3COCH2COH(CH3)2(aq);取相同浓度的CH3COCH3,分别在40℃和60℃时,测得其转化率
CH3COCH2COH(CH3)2(aq);取相同浓度的CH3COCH3,分别在40℃和60℃时,测得其转化率 随时间变化的关系曲线(
随时间变化的关系曲线( )如图所示。
)如图所示。


 CO (g)+H2O(g) △H>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是
CO (g)+H2O(g) △H>0,达到平衡后,为提高该反应的速率和CO2的转化率,采取的正确措施是