题目内容
下列关于共价键的说法不正确的是( )
| A、H2S分子中两个共价键的键角接近90°的原因是共价键有方向性 |
| B、N2分子中有1个σ键,2个π键 |
| C、两个原子形成共价键时至少有1个σ键 |
| D、在双键中,σ键的键能小于π键的键能 |
考点:共价键的形成及共价键的主要类型
专题:
分析:A.共价键有方向性和饱和性;
B.N2分子中存在N≡N,有一个σ键、两个π键.
C.σ键是电子“头对头”重叠形成的;
D.双键的键能小于单键键能的2倍;
B.N2分子中存在N≡N,有一个σ键、两个π键.
C.σ键是电子“头对头”重叠形成的;
D.双键的键能小于单键键能的2倍;
解答:
解:A.共价键是原子之间通过共用电子对形成,所以共价键有方向性和饱和性,故A正确;
B.N2分子中存在N≡N,则有一个σ键、两个π键,故B正确;
C.σ键是头碰头形成的,两个原子之间能形成一个,故C正确;
D.双键的键能小于单键键能的2倍,又双键中1个σ键,1个π键,而单键1个σ键,所以σ键的键能大于π键的键能,故D错误;
故选:D.
B.N2分子中存在N≡N,则有一个σ键、两个π键,故B正确;
C.σ键是头碰头形成的,两个原子之间能形成一个,故C正确;
D.双键的键能小于单键键能的2倍,又双键中1个σ键,1个π键,而单键1个σ键,所以σ键的键能大于π键的键能,故D错误;
故选:D.
点评:本题考查共价键的形成及类型,把握电子层重叠方式和判断共价键类型的一般规律即可解答,侧重分子结构与性质的考查,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
结构简式为(CH3)3CCH2CH3的烷烃,进行二氯取代反应后,生成的二氯取代产物有( )(不考虑立体异构)
| A、6种 | B、7种 | C、8种 | D、9种 |
下列物质的水溶液能导电,但属于非电解质的是( )
| A、H2SO4 |
| B、C2H5OH |
| C、NH4SO4 |
| D、SO2 |
下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
| A、常温下,28gFe与足量的浓硝酸反应,转移的电子数为1.5NA |
| B、标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2 |
| C、3.2g铜在硫蒸气中完全燃烧,转移的电子数为0.1NA |
| D、常温常压下,0.1mol氖气含有的电子数为NA |
下列反应中生成物总能量高于反应物总能量的是( )
| A、乙醇燃烧 |
| B、氯酸钾分解制氧气 |
| C、铝片和盐酸反应 |
| D、氧化钙溶于水 |
A、B、C三种短周期元素在元素周期表中的相对位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数,以下说法中不正确的是( )
| A | B |
| C |
| A、B与C均存在同素异形体 |
| B、X的种类比Y的多 |
| C、C的最高价氧化物对应水化物能与A的氢化物形成三种盐 |
| D、沸点:A的氢化物低于C的氢化物 |
下列说法不正确的是( )
| A、分散质粒子直径介于1~100 nm之间的分散系称为胶体 |
| B、江河入海口三角洲的形成通常与胶体的性质有关 |
| C、用激光笔检验淀粉溶液的丁达尔效应 |
| D、向煮沸的1 mol?L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
NA代表阿伏加德常数,下列说法中,正确的是( )
| A、1mol/LFeCl3溶液中Fe3+数目为NA个 |
| B、2g氢气所含原子数目为NA |
| C、在常温常压下,11.2L氮气所含的原子数目为NA |
| D、17gNH3所含电子数目为10NA |
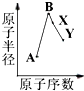 A、B、X、Y是常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;Y的单质是一种常见的半导体材料;X在空气中燃烧可生成两种化合物.
A、B、X、Y是常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;Y的单质是一种常见的半导体材料;X在空气中燃烧可生成两种化合物.