题目内容
15.A、B、C、D均为含两个碳原子的有机化合物(相互转化关系如图)其中 D是一种最常见食用有机酸,在反应①的混合液中加过量的稀硝酸后再加硝酸银溶液产生白色沉淀.
(1)写出A的分子式:C2H5Cl,C的结构式

(2)写出下列方程式:
写出反应①:CH3CH2Cl+NaOH$→_{△}^{水}$ CH3CH2OH+NaCl
写出B与D在一定条件下发生的反应:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
分析 A、B、C、D均为含两个碳原子的有机化合物,其中D是一种最常见食用有机酸,则D为CH3COOH,逆推可知C为CH3CHO,B为CH3CH2OH,在A与氢氧化钠水溶液、加热条件下反应得到的混合液中加过量的稀硝酸后再加硝酸银溶液产生白色沉淀,说明A中含有Cl元素,故A为CH3CH2Cl.
解答 解:A、B、C、D均为含两个碳原子的有机化合物,其中D是一种最常见食用有机酸,则D为CH3COOH,逆推可知C为CH3CHO,B为CH3CH2OH,在A与氢氧化钠水溶液、加热条件下反应得到的混合液中加过量的稀硝酸后再加硝酸银溶液产生白色沉淀,说明A中含有Cl元素,故A为CH3CH2Cl.
(1)A为CH3CH2Cl,A的分子式:C2H5Cl,C为CH3CHO,结构式为: ,
,
故答案为:C2H5Cl; ;
;
(2)反应①的方程式为:CH3CH2Cl+NaOH$→_{△}^{水}$ CH3CH2OH+NaCl,
B与D在一定条件下发生的反应:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH3CH2Cl+NaOH$→_{△}^{水}$ CH3CH2OH+NaCl;CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
点评 本题考查有机物的推断,涉及卤代烃、醇、醛、羧酸、酯的性质与转化,比较基础,注意根据醇的连续氧化反应进行推断,熟练掌握官能团的性质.

练习册系列答案
相关题目
5.下列物质,不能使高锰酸钾溶液褪色的是( )
| A. | 乙烯 | B. | 苯 | C. | 乙炔 | D. | 乙醛 |
6.下列说法不正确的是( )
| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 对于CaCO3(s)═CaO(s)+CO2(g) 任何温度下都不能自发进行 | |
| C. | 实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g),△H=+489.0 kJ/mol. CO(g)+$\frac{1}{2}$O2(g)═CO2(g),△H=-283.0 kJ/mol. C(石墨)+O2(g)═CO2(g),△H=-393.5 kJ/mol. 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0 kJ/mol |
3.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用,下表列出了①~⑨九种元素在周期表中的位置.
回答下列问题:
(1)编号元素中,化学性质最不活泼的元素的原子结构示意图是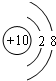 .
.
(2)九种元素中非金属最强的是F(填元素符号),元素⑧的氢化物的结构式为H-Cl.
(3)除⑨外,原子半径最大的是Na(元素符号).在①、②、③三种元素的最高价氧化物对应的水化物中,碱性最强的是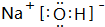 (填电子式),其所含有的化学键类型有离子键、极性共价键(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
(填电子式),其所含有的化学键类型有离子键、极性共价键(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
(4)⑥、⑦、⑧三种元素的气态氢化物的稳定性由强到弱的顺序是HF>HCl>H2S(填化学式).
(5)元素④对应的氢化物的电子式为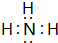 ,其水溶液呈碱性(填“酸性”、“中性”或“碱性”).
,其水溶液呈碱性(填“酸性”、“中性”或“碱性”).
(6)⑦、⑧两种元素最高价氧化物对应的水化物的酸性由强到弱的顺序是HClO4>H2SO4(填化学式).
(7)①、⑥离子的电子层结构与⑨原子的电子层结构相同,这两种离子的半径由大到小的顺序是F->Na+(填离子符号).
(8)九种元素中的最高价氧化物对应的水化物呈两性的氢氧化物与烧碱溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑨ | ||||
| 3 | ① | ② | ③ | ⑦ | ⑧ |
(1)编号元素中,化学性质最不活泼的元素的原子结构示意图是
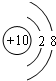 .
.(2)九种元素中非金属最强的是F(填元素符号),元素⑧的氢化物的结构式为H-Cl.
(3)除⑨外,原子半径最大的是Na(元素符号).在①、②、③三种元素的最高价氧化物对应的水化物中,碱性最强的是
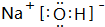 (填电子式),其所含有的化学键类型有离子键、极性共价键(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).
(填电子式),其所含有的化学键类型有离子键、极性共价键(请选择“离子键”、“极性共价键”、“非极性共价键”中的一个或几个填写).(4)⑥、⑦、⑧三种元素的气态氢化物的稳定性由强到弱的顺序是HF>HCl>H2S(填化学式).
(5)元素④对应的氢化物的电子式为
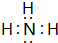 ,其水溶液呈碱性(填“酸性”、“中性”或“碱性”).
,其水溶液呈碱性(填“酸性”、“中性”或“碱性”).(6)⑦、⑧两种元素最高价氧化物对应的水化物的酸性由强到弱的顺序是HClO4>H2SO4(填化学式).
(7)①、⑥离子的电子层结构与⑨原子的电子层结构相同,这两种离子的半径由大到小的顺序是F->Na+(填离子符号).
(8)九种元素中的最高价氧化物对应的水化物呈两性的氢氧化物与烧碱溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
10.生活中的一些小常识往往包含化学知识,以下叙述不正确的是( )
| A. | 用热的纯碱水洗涤油污 | |
| B. | 用食醋消除暖水瓶中的水垢 | |
| C. | 用碘水来检测成熟的苹果中是否含有淀粉 | |
| D. | 纤维素在人体内可水解为葡萄糖,故可作为人类的营养物质 |
20.关于有机物C3H6O3的下列叙述一定正确的是( )
| A. | 若能与金属钠和碳酸氢钠反应,则其结构中同时含有-OH和-COOH | |
| B. | 若该物质中含有两个-CH3,则它可以是碳酸酯 | |
| C. | 若该物质中结构中不能只含有C-O键和C-H键 | |
| D. | 若1mol C3H6O3与足量钠反应只产生1mol氢气,说明一分子C3H6O3中含有2个-OH和一个-CHO |
4.下列化学用语书写正确的是( )
| A. | 醋酸与NaOH溶液反应的离子方程式为:H++OH-═H2O | |
| B. | 金属钠与乙醇反应的化学方程式为:2Na+2CH3CH2OH→2CH3CH2ONa+H2↑ | |
| C. | 聚氯乙烯的结构简式为: | |
| D. | 工业上制取Cl2的离子方程式为:2Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ |
16.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,在空气中迅速被氧化成绿色,见光分解变成褐色;如图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
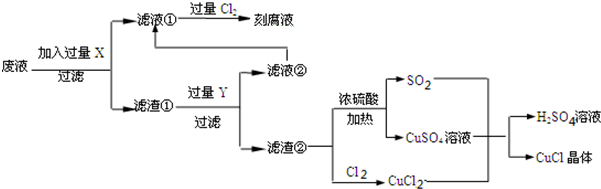
根据以上信息回答下列问题:
(1)该生产过程可以与氯碱工业、硫酸工业生产相结合,现代氯碱工业的装置名称是离子交换膜电解槽_此空删去.
(2)流程中的X是Fe,Y是HCl (均填化学式).
(3)产生CuCl的化学方程式为CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)为了提髙CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水洗涤而用无水乙醇洗涤,其目的是CuCl微溶于水、不溶于乙醇,用乙醇洗涤可减少产品CuCl的损失,生产过程中控制溶液的pH不能过大的原因是溶液pH大会促进CuCl的水解.
(5)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是防止CuCl的氧化和见光分解.
(6)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的FeCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL、邻菲罗啉指示剂2滴;
③立即用0.10mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点.同时做空白试验一次.已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+,如此再重复二次实验得到以下数据:
(说明:空白试验指在不加试样的情况下按试样分析规程在同样的操作条件下进行的分析,所得结果的数值为空白值)
④数据处理:计算得该工业CuCl的纯度为95%.(平行实验结果相差不能超过0.3%)

根据以上信息回答下列问题:
(1)该生产过程可以与氯碱工业、硫酸工业生产相结合,现代氯碱工业的装置名称是离子交换膜电解槽_此空删去.
(2)流程中的X是Fe,Y是HCl (均填化学式).
(3)产生CuCl的化学方程式为CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)为了提髙CuCl产品的质量,采用抽滤或者减压过滤法快速过滤,析出的CuCl晶体不用水洗涤而用无水乙醇洗涤,其目的是CuCl微溶于水、不溶于乙醇,用乙醇洗涤可减少产品CuCl的损失,生产过程中控制溶液的pH不能过大的原因是溶液pH大会促进CuCl的水解.
(5)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是防止CuCl的氧化和见光分解.
(6)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的FeCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL、邻菲罗啉指示剂2滴;
③立即用0.10mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点.同时做空白试验一次.已知:CuCl+FeCl3=CuCl2+FeCl2 Fe2++Ce4+=Fe3++Ce3+,如此再重复二次实验得到以下数据:
| 1 | 2 | 3 | |
| 空白试验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得该工业CuCl的纯度为95%.(平行实验结果相差不能超过0.3%)