题目内容
选择下列实验方法分离物质,将分离方法的序号填在横线上.
A.萃取分液 B.蒸发结晶 C.分液 D.蒸馏 E、过滤
(1) 分离饱和食盐水和沙子的混合物.
(2) 分离水和汽油的混合物.
(3) 分离CCl4(沸点为76.75○C)和甲苯(沸点为110.6○C)的混合物.
(4) 将碘从碘水中提取出来.
(5) 从硫酸钾溶液中得到硫酸钾固体.
A.萃取分液 B.蒸发结晶 C.分液 D.蒸馏 E、过滤
(1)
(2)
(3)
(4)
(5)
考点:物质的分离、提纯的基本方法选择与应用
专题:化学实验基本操作
分析:(1)沙子不溶于水,NaCl溶于水;
(2)水和汽油会分层;
(3)CCl4与甲苯混溶,利用沸点不同分离;
(4)碘在水中溶解度较小,但易溶于有机溶剂;
(5)用蒸发结晶的方法从溶液中提取溶质.
(2)水和汽油会分层;
(3)CCl4与甲苯混溶,利用沸点不同分离;
(4)碘在水中溶解度较小,但易溶于有机溶剂;
(5)用蒸发结晶的方法从溶液中提取溶质.
解答:
解:(1)饱和食盐水与沙子为固体与液体不互溶的混合物,可用过滤方法分离,故答案为:E;
(2)水和汽油互不相溶,会分层,可用分液的方法分离,故答案为:C;
(3)四氯化碳和甲苯互溶,但二者沸点相差较大,可用蒸馏的方法分离,故答案为:D;
(4)碘在水中溶解度较小,碘易溶于苯等有机溶剂,可用萃取的方法分离,故答案为:A;
(5)用蒸发结晶的方法从溶液中提取溶质,则从硫酸钾溶液中得到硫酸钾固体,故答案为:B.
(2)水和汽油互不相溶,会分层,可用分液的方法分离,故答案为:C;
(3)四氯化碳和甲苯互溶,但二者沸点相差较大,可用蒸馏的方法分离,故答案为:D;
(4)碘在水中溶解度较小,碘易溶于苯等有机溶剂,可用萃取的方法分离,故答案为:A;
(5)用蒸发结晶的方法从溶液中提取溶质,则从硫酸钾溶液中得到硫酸钾固体,故答案为:B.
点评:本题考查混合物的分离、提纯,明确物质的性质及性质差异选择分离方法即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图.下列说法正确的是( )

| A、CaSO4在稀硫酸中的溶解性比在纯水中的溶解性 强 |
| B、b点将有沉淀生成,平衡后溶液中c(SO42-)一定等 于3×10-3 mol/L |
| C、d点溶液通过蒸可以变到c点 |
| D、a点对应的Ksp等于c点对应的Ksp |
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) | ||
| B、0.1mol/LH2SO4与0.1mol/L氨水等体积混合:c(H+)>c(NH4+)>c(SO42-)>c(OH-) | ||
C、0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:
| ||
| D、0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
下列分子或离子在指定条件的分散系中能大量共存的是( )
| A、Ca(NO3)2溶液中:Fe2+、H+、Cl-、SO42- |
| B、使pH试纸变蓝的溶液中:K+、NH4+、S-、SO32- |
| C、水电离出的c(H+)=10-12 mol?L-1的溶液中:Na+、Ba2+、HCO3-、CH3COO- |
| D、透明的强酸性溶液中:Al3+、Fe3+、Cl-、SO42 |
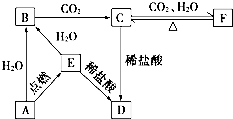 如图所示,下列各项变化的未知物焰色反应均呈黄色,E为淡黄色粉末.回答下列问题.
如图所示,下列各项变化的未知物焰色反应均呈黄色,E为淡黄色粉末.回答下列问题.