题目内容
15.下列应用化学科学对物质进行研究的基本方法或所得的结论,错误的是( )| A. | 氢气和甲烷的密度都比空气的小,所以都可用向下排气法收集 | |
| B. | 配制溶质质量分数一定的溶液时,所用的烧杯必须是干燥的 | |
| C. | 蜡烛燃烧后质量变小,说明质量守恒定律不是普遍规律 | |
| D. | 通过测定两种稀盐酸的pH,可以比较它们的酸性强弱 |
分析 A.密度比空气小的气体可以用向下排气法收集;
B.烧杯干燥,配制出来的溶液的质量分数才是准确的;
C.化学反应都遵循质量守恒定律;
D.盐酸的pH越小,酸性越强.
解答 解:A.氢气和甲烷的密度都比空气的小,所以都可用向下排气法收集,故A正确;
B.配制溶质质量分数一定的溶液时,所用的烧杯必须是干燥的,这样配制出来的溶液的质量分数才是准确的,故B正确;
C.蜡烛燃烧后生成的二氧化碳和水蒸气扩散到空气中去了,故蜡烛的质量变小了,遵循质量守恒定律,故C错误;
D.通过测定两种稀盐酸的pH,可以比较它们的酸性强弱,故D正确;
故选:C.
点评 本题为综合题,考查了气体收集方法、溶液的配制、质量守恒定律、溶液pH值与溶液酸碱性关系,题目难度不大,熟悉相关知识是解题关键,侧重考查学生对基础知识掌握熟练程度.

练习册系列答案
相关题目
5.CoCl2•6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如下:
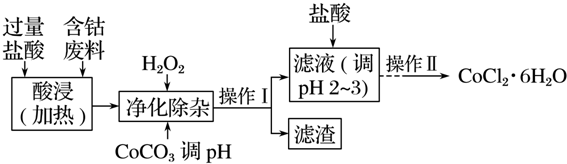
已知:
(1)净化除杂质时,加入H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为Fe(OH)3、Al(OH)3.
(3)加盐酸调整pH为2~3的目的为抑制CoCl2水解.
(4)操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤、洗涤、干燥.其中洗涤的操作为在过滤器中加入蒸馏水使水没过晶体,静置,使其自然流下,重复2-3次.

已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
(2)加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为Fe(OH)3、Al(OH)3.
(3)加盐酸调整pH为2~3的目的为抑制CoCl2水解.
(4)操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤、洗涤、干燥.其中洗涤的操作为在过滤器中加入蒸馏水使水没过晶体,静置,使其自然流下,重复2-3次.
6.节能减排是社会赋予的责任和使命,从衣、食、住、行、用等方面,下列行为不利于低碳生活的是( )
①用LED半导体节能照明灯代替传统的白炽灯
②购物时提倡用超薄一次性塑料袋
③推广使用一次性筷子
④在农村推广沼气照明和供热
⑤用大排量的轿车代替公交车出行.
①用LED半导体节能照明灯代替传统的白炽灯
②购物时提倡用超薄一次性塑料袋
③推广使用一次性筷子
④在农村推广沼气照明和供热
⑤用大排量的轿车代替公交车出行.
| A. | ③④⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①②⑤ |
3.进行化学实验必须注意安全,下列说法正确的是( )
| A. | 不慎将酸溅到眼中,应立即用干布擦,后边洗边眨眼睛 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 酒精在实验台上燃烧时,用水扑灭火焰 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
10.如图是甲、乙、丙三种不同物质(不含结晶水)的溶解度曲线图.下列有关叙述正确的是( )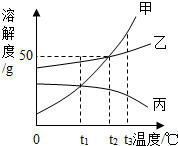

| A. | t1℃时,分别取出相同质量的甲、丙两种饱和溶液升温到t2℃时,甲和乙溶质的质量分数相等 | |
| B. | t2℃时,将甲、乙两种饱和溶液分别恒温蒸发等质量的水,析出晶体的质量可能不等 | |
| C. | 将三种饱和溶液分别从t3℃降低到t2℃时,甲和乙溶质的质量分数减小,丙的溶质的质量分数不变 | |
| D. | 当甲的饱和溶液中含有少量乙时,可以采取冷却热饱和溶液的办法提取乙 |
20.氰(CN)2与氯气的性质相似,下表所示是氰与氯气的部分性质.( )
| 物质 | 熔点/℃ | 沸点/℃ | 水溶性 |
| (CN)2 | -34 | -21.2 | 可溶 |
| Cl2 | -101 | -34 | 可溶 |
| A. | 二者均为非金属单质 | |
| B. | 标况下,氰的体积大于氯气的体积 | |
| C. | 同温同压下,相同质量的氰和氯气,前者含有的原子多 | |
| D. | 标况下,氰与氯气的密度之比为71:52 |
7.下列反应或变化中属于放热反应的是( )
| A. | C+CO2 $\frac{\underline{\;加热\;}}{\;}$2CO | B. | 2H2+O2 $\frac{\underline{\;高温\;}}{\;}$2H2O | ||
| C. | CaCO3 $\frac{\underline{\;点燃\;}}{\;}$ CaO+CO2 | D. | 水蒸汽凝结成水 |
4.一些烷烃的燃烧热如表:
下列表达正确的是( )
| 化合物 | 燃烧热/kJ/mol | 化合物 | 燃烧热/kJ/mol |
| 甲烷 | 891.0 | 正丁烷 | 2 878.0 |
| 乙烷 | 1 560.8 | 异丁烷 | 2 869.6 |
| 丙烷 | 2 221.5 | 2甲基丁烷 | 3 531.3 |
| A. | 正戊烷的燃烧热大于3 531.3 kJ•mol-1 | |
| B. | 稳定性:正丁烷>异丁烷 | |
| C. | 乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1 560.8 kJ•mol-1 | |
| D. | 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
5.下列物质的水溶液因水解呈碱性的是( )
| A. | NH4Cl | B. | MgSO4 | C. | KOH | D. | NaClO |