题目内容
12.在标准状况下,CO和CO2的混合气体共39.2L,质量为61g.则两种气体的物质的量之和为1.75mol,其中CO2为0.75mol,CO的质量分数为45.9%.分析 根据n=$\frac{V}{{V}_{m}}$计算出混合气体的物质的量;设出CO和CO2的物质的量,然后分别根据气体总物质的量、总质量列式计算;根据m=nM计算出CO的质量,再计算出CO的质量分数.
解答 解:标准状况下39.2L CO和CO2的混合气体的物质的量为:$\frac{39.2L}{22.4L/mol}$=1.75mol,
设混合气体中CO和CO2的物质的量分别为x、y,
则:$\left\{\begin{array}{l}{28x+44y=61}\\{x+y=1.75}\end{array}\right.$,解得:$\left\{\begin{array}{l}{x=1mol}\\{y=0.75mol}\end{array}\right.$
即混合气体中CO为1mol,二氧化碳的物质的量为0.75mol,
1molCO的质量为:28g/mol×1mol=28g,则混合气体中CO的质量分数为:$\frac{28g}{61g}$×100%≈45.9%,
故答案为:1.75;0.75;45.9%.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积之间的转化关系为解答关键,注意掌握质量分数的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
2.某酸碱指示剂(HIn)在水溶液中存在以下平衡:
HIn(aq)?H++In-(aq)
(红色) (蓝色)
下列物质的溶液中,能使指示剂显蓝色的是( )
HIn(aq)?H++In-(aq)
(红色) (蓝色)
下列物质的溶液中,能使指示剂显蓝色的是( )
| A. | 稀硫酸 | B. | 氯化铝溶液 | C. | 稀氨水 | D. | 饱和食盐水 |
3.据《天工开物》记载,我国古代以炉甘石(主要成分是ZnCO3)来升炼倭铅(即锌),其原理如图2.已知锌的熔点420℃、沸点906℃.则下列说法错误的是( )
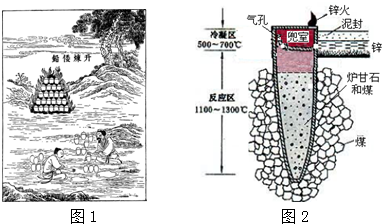

| A. | “泥封”的目的是为了防止得到的锌被氧化 | |
| B. | “锌火”是锌蒸气和一氧化碳在空气的燃烧 | |
| C. | 冶炼时锌变为蒸气在兜室冷凝为固体 | |
| D. | 升炼倭铅过程包含分解反应和氧化还原反应 |
17.在pH=1溶液中能大量共存的是( )
| A. | Na+、SO42-、Ba2+、Cl- | B. | Na+、K+、CH3COO-、NO3- | ||
| C. | H+、Cu2+、OH-、CO32- | D. | K+、Na+、Cl-、NO3- |
4.下列事实能说明相应的酸是弱电解质的是( )
| A. | 用HR做导电实验,灯泡很暗 | |
| B. | 0.1mol•L-1HR溶液稀释到100倍时,溶液的pH值为3 | |
| C. | 20mL0.1mol•L-1HR恰好中和20mL0.1mol•L-1NaOH溶液 | |
| D. | 0.1mol•L-1NH4R溶液的pH等于7 |
1.下列物质中,属于纯净物的是( )
| A. | 白酒 | B. | 石灰石 | C. | 冰水 | D. | 矿泉水 |
7.(1)I.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第IIIA族.
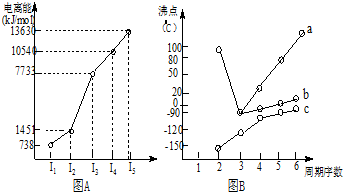
II.图B折线c可以表达出第IVA族元素氢化物的沸点的变化规律;两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线:a和b,你认为正确的是:b(填“a”或“b”).
已知部分有机物的熔沸点见下表:
由这些数据你能得出的结论是(至少写2条):有机物相对分子质量越大,分子间作用力越强,故沸点越高,当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高;.
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母).
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(3)金属是钛(Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布方式为3d24s2;
II.钢铁表面镀有下列金属时,当镀层部分被破坏时,铁不易被腐蚀的是b.(填字母)
a.Sn b.Zn c.Cu d.Pb.

II.图B折线c可以表达出第IVA族元素氢化物的沸点的变化规律;两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线:a和b,你认为正确的是:b(填“a”或“b”).
已知部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 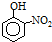 | 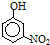 | 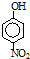 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母).
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(3)金属是钛(Ti) 将是继铜、铁、铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布方式为3d24s2;
II.钢铁表面镀有下列金属时,当镀层部分被破坏时,铁不易被腐蚀的是b.(填字母)
a.Sn b.Zn c.Cu d.Pb.